本文转载自“Hanson临床科研”微信公众号。
2021年8月9日(本周一),澳大利亚药品管理局授予美国默沙东公司Molnupiravir临时决定,从而默沙东可以在澳大利亚注册申请Molnupiravir的新药上市。
在感染早期,病毒快速复制,而宿主的免疫系统尚未有足够的时间建立免疫防御,所以抗病毒药物治疗阻断病毒的最佳时间是在感染的前几天。而Molnupiravir正是设计用于疾病早期门诊使用,且为口服胶囊,所以受益人群将会大大增加。
Molnupiravir是针对RNA病毒的广谱抗病毒药物。我从去年年初开始就做了很多介绍,认为这个抗病毒小分子对于SARS-CoV-2具有良好的抗病毒活性。
2021年6月21日上传于medRxiv、由美国北卡莱罗纳大学(UNC)主研的临床试验中,治疗后3天,Molnupiravir治疗800mg组患者可分离复制型病毒概率显著低于安慰剂组(1.9% vs. 16.7%,p = 0.02),这是一个检定病毒传染性的金标准。治疗5天后,400和800mg组患者均无法分离出复制型病毒,安慰剂组11.1%患者可分离出复制型病毒(p = 0.03)。
2021年8月11日,马普研究所在Nature SME发表了一篇很好的文章,报道了潜在的高效抗病毒药Molnupiravir的分子作用机制。
这项研究介绍了Molnupiravir诱导病毒RNA复制发生突变的机制。Molnupiravir的活性形式是β-D-N4-羟基胞苷(NHC)-三磷酸,病毒的RdRp会错误使用NHC-三磷酸,而不使用三磷酸胞苷或三磷酸尿苷作为催化底物。
NHC会使病毒RNA复制掺入大量A和G,从而导致RNA产物发生突变。包含诱变产物的RdRp-RNA复合物的结构分析表明,NHC可以与 RdRp活性中心的G或A形成稳定的碱基对,这解释了该药物如何逃避校对并合成突变的RNA。
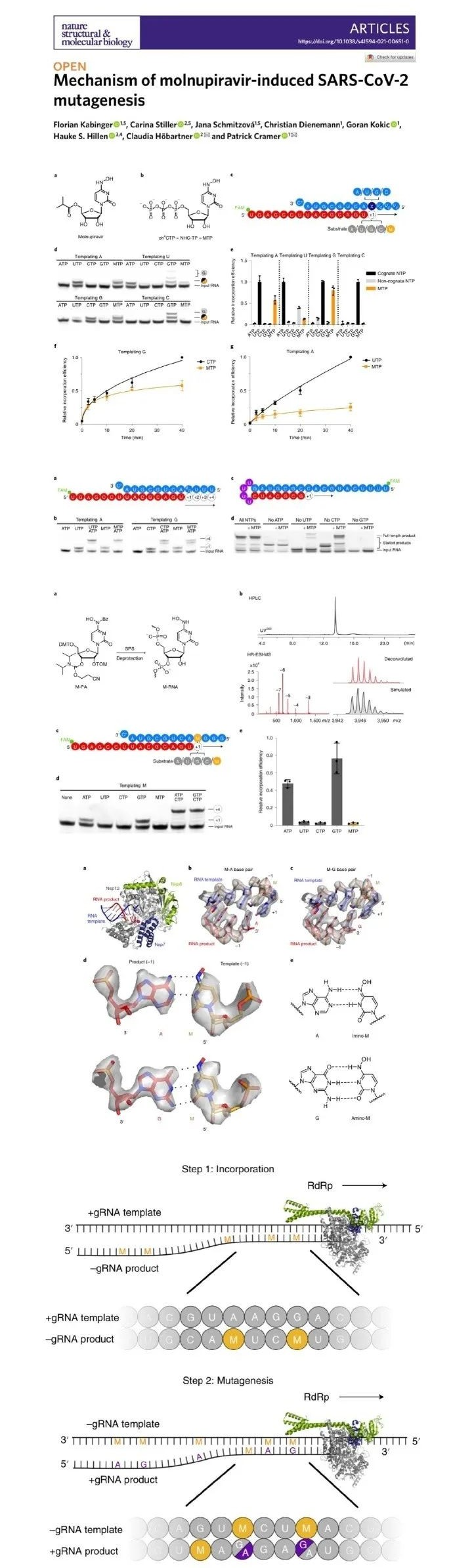
这种两步诱变机制可能适用于各种病毒聚合酶,因此Molnupiravir可具有广谱抗RNA病毒的活性。
2021年6月,美国拜登政府即承诺,如果美国FDA给予Molnupiravir紧急使用授权,将购买170万个疗程的Molnupiravir,价值约合12亿美元。
早在2020年2月4日,我们在讨论瑞德西韦治疗新冠肺炎的时候,就提到:抗病毒治疗+单抗联合,是治疗新冠肺炎的理想方法。
同时,新型冠状病毒以及其他引起严重肺炎的病毒所面临的挑战是:治疗时间窗。也就是越早治疗,效果越好。
这也意味着,需要口服药物。
而在治疗轻中度COVID-19的单抗研发方面,目前已经批准了三个药物:
A,美国再生元公司的单克隆抗体鸡尾酒REGEN-COV;
B,美国Vir Biotechnology与葛兰素史克联合研发的单抗Sotrovimab (VIR-7831) ;
C,礼来公司的单抗Bamlanivimab是第一个获批,但由于突变株而被取消紧急使用授权;后bamlanivimab and etesevimab再次获批,但6月25日再次暂停发放。
且目前已有得到单抗都是针剂,严重限制了临床使用。
吉利德公司研发的瑞德西韦也是针剂,所以无法在门诊早期使用;随着2021年7月30日,吉利德公司宣布停止瑞德西韦吸入剂的临床试验,目前早期治疗COVID-19口服抗病毒制剂的希望,就落在了Molnupiravir身上。
身负众多期望,祝Molnupiravir早日上市。