导语:产后抑郁症(postpartum depression,PPD)是一种分娩后发生的的情感障碍,症状包括悲伤和/或对过去喜欢的活动失去兴趣,感觉快乐的能力下降,出现认知障碍、无价值感或内疚感等,多半出现于婴儿出生后的一周到一个月时间,不仅对母亲的健康产生重大不利影响,对婴儿的发育也有负面而持久的影响,严重者会出现伤害婴儿及自杀的倾向。然而,这群患者的用药需求并未得到充分满足。
“第一个吃螃蟹”的Zulresso
2019年,FDA批准了史上第一款专门用于治疗产后抑郁症的药物Brexanolone(商品名Zulresso)。Zulresso是一款静脉注射液,由美国生物制药公司Sage Therapeutics研发。不同于传统的抗抑郁药物,Zulresso并非通过抑制五羟色胺和去甲肾上腺素的再摄取来起效,而是通过和大脑内的GABAA受体结合,增加该受体上氯离子通道的开放频率,降低神经兴奋性等产生抗抑郁和抗焦虑作用。

图1 Zulresso(图源:DrugTopics)
Zulresso起效极快,患者用药48小时后中重度抑郁症状就会得到缓解,而一般的抗抑郁药通常需要2-4周才能起效。该药物的主要成分为四氢孕酮,由于其很少经乳汁分泌,因此对婴儿具有良好的安全性,但四氢孕酮无法口服,否则将被快速代谢掉,因此药厂将其开发为注射剂形式,通过续静脉注射60小时(2.5天)缓慢给药来保证稳定的血药浓度和治疗作用。
但这也使得用药必须住院。此外,该药物存在过度镇静和意识突然丧失等副作用,需要医护人员在注射过程中对患者进行全程监护,医疗机构也必须获得给药资格才能对患者进行治疗。Zulresso的价格也十分高昂,每瓶售价7450美元,整个疗程的费用为3.4万美元,保险公司也因此不把Zulresso作为治疗产后抑郁症的首选,只有在其他多种药物无效后才考虑批准使用。这些因素都局限了Zulresso的可及性。
站在前人的肩膀上
值得期待的是,2022年12月,由Sage Therapeutics和百健(Biogen)合作研发的第二款产后抑郁症药物Zuranolone已完成向FDA滚动提交新药申请。在2023年摩根大通医疗健康年会(J.P. Morgan Healthcare Conference)上,Sage Therapeutics的首席执行官 Barry Greene向观众列举了Zuranolone优于现有药物的一系列特性,尤其是其口服形式和速效特性。
Zurunolone也是一种神经活性类固醇,作用机理和Zulresso类似,有助于快速重新平衡失调的神经元网络,从而帮助改善大脑功能。但作为后者的改版,Zurunolone具有高口服生物利用度,生物半衰期为16至23小时,更适合每日一次的给药。
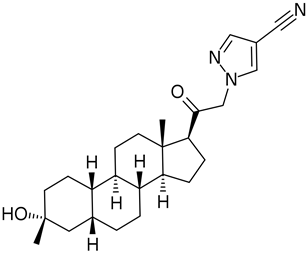
图2 Zurunolone分子结构(图源:wikipedia)
Sage Therapeutics和百健分别在2022年的6月和10月发布了Zurunolone治疗产后抑郁症的3期SKYLARK试验的主要终点和次要终点结果数据,结果显示,200名在17项汉密尔顿抑郁量表中得分等于或高于26的女性,在每晚接受一次50mg Zurunolone持续14天后,评分下降了15.6,相较于安慰剂组的11.6,差异达到其主要终点。在第3天、第28天和第45天时,Zuranolone的表现也优于安慰剂。

图3 Zuranolone不同适应症开发进度(图源:Sage Therapeutics官网)
此外,Sage Therapeutics和百健还展开了LANDSCAPE临床项目,该项目包括五项针对重度抑郁症成人患者服用Zuranolone的研究。从公司官网资料可以看到,Zuranolone开发中的适应症还包括难治性抑郁症、广泛性焦虑症和双相抑郁症。如能覆盖更大的适应症,Zuranolone将获得更广阔的市场,尤其重度抑郁症的患者人群要比产后抑郁症庞大许多。
但Sage Therapeutics方面依旧十分看重产后抑郁症的市场。Greene和首席商务官Chris Benecchi特别驳斥了此前有分析师提出的产后抑郁症是一种“利基”适应症的说法(利基指市场狭小且未被满足),称每年被诊断患有这种疾病的母亲高达50万人,即每8个活产中就有1人,而这些患者尚无口服药物的选择。
Zulresso的经验也给了Sage Therapeutics推广Zuranolone的更多信心。Benecchi表示:“它使我们能够真正了解 PPD市场本身的治疗或转诊模式,并与患者权益团体建立牢固的工作关系。”公司与付款人的合作也将有助于Zuranolone的上市。
Greene表示,母亲的产后抑郁症通常由产科医生和儿科医生发现,但通常需要几个月的时间才能康复,这将超出患者接受治疗的时间范围,而Zuranolone则符合该场景下的治疗时间线。
Zuranolone是否会获得FDA的优先审查仍然未知,但Sage Therapeutics方面相信这只关乎到FDA是否有充足的人手,而非对Zuranolone填补市场空白能力的质疑。不论是优先审查,还是标准审查,公司都已做好准备。
参考资料:
[1]https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-post-partum-depression
[2]https://wellsuremed.com/34000一疗程,史上首款专门治疗产后抑郁症的药物,/
[3]https://www.fiercebiotech.com/biotech/jpm23-sage-ceo-says-post-partum-depression-no-niche-zuranolone-aims-fill-gaps-depression
[4]https://investors.biogen.com/news-releases/news-release-details/biogen-and-sage-therapeutics-complete-rolling-submission-new
[5]https://www.fiercebiotech.com/biotech/skylark-sings-sage-biogen-hatch-positive-phase-3-data-postpartum-depression