Paxlovid被称为“有效药”,
但绝不是“特效药”
未经高级别医师评估,
个人绝不能私自服用
在很多人的预想中,国内防疫政策什么时候全面放开最好呢?
回答是,等80岁以上的老年人全程接种了疫苗(不论是灭活、蛋白重组,还是RNA疫苗,都行),等国内一些药企研发出了较为成熟的国产新冠药物,等医院的急诊、重症医疗资源配备的比较充足之后,再全面放开,那将会是一种非常从容不迫的状态。
但迫于一些压力和情绪,这些都是国家层面理想的、未能如愿的美好规划。拿新冠治疗药物来说,随着城市重症潮的到来,作为全世界最受关注的新冠口服抗病毒药,辉瑞Paxlovid频频成为中国人眼中的神药,这导致原本临时医保支付价1890元一盒的药物一度被黄牛炒到1万多一盒。
在宣传中,似乎个人只要吃了Paxlovid,就能在新冠感染中安全无虞,这种想法令人感到害怕。Paxlovid在降低住院死亡率和重症方面确实有效,这是无疑的。但只能称为有效,甚至算不上特效,因为其主要作用是早期降低重症,而不能治疗重症,目前为止,全球也没有真正意义上的新冠特效药。
关于Paxlovid有效性的科学研究主要有两个,一个是2021年11月5日辉瑞发布了一项研究,宣称在第二、三期的临床试验的分析中,Paxlovid将住院或死亡风险降低了89%,而另一款临床试验药物——默沙东的莫诺拉韦,将轻度、中度新冠患者的住院或死亡风险降低了约50%。
另一项研究是2022年10月8日《柳叶刀》上的文章,其发布了一项中国香港关于两款新冠口服药莫诺拉韦和Paxlovid对治疗奥密克戎感染有效性的真实世界研究。

图1 研究成果(图源:《柳叶刀》)
研究中,在2022年2月26日-6月26日期间,11847名非住院新冠患者早期使用莫诺拉韦或Paxlovid治疗,他们中大多属于新冠感染高危人群,且年龄超过60岁,未完成疫苗接种。
结果发现,与安慰剂对照组相比,莫诺拉韦治疗组的全因死亡率为17.9/10万人日,降低了24%;而Paxlovid治疗组则为4.2/10万人日,相比对照组降低66%,住院风险降低了24%,住院后疾病进展风险降低了43%。
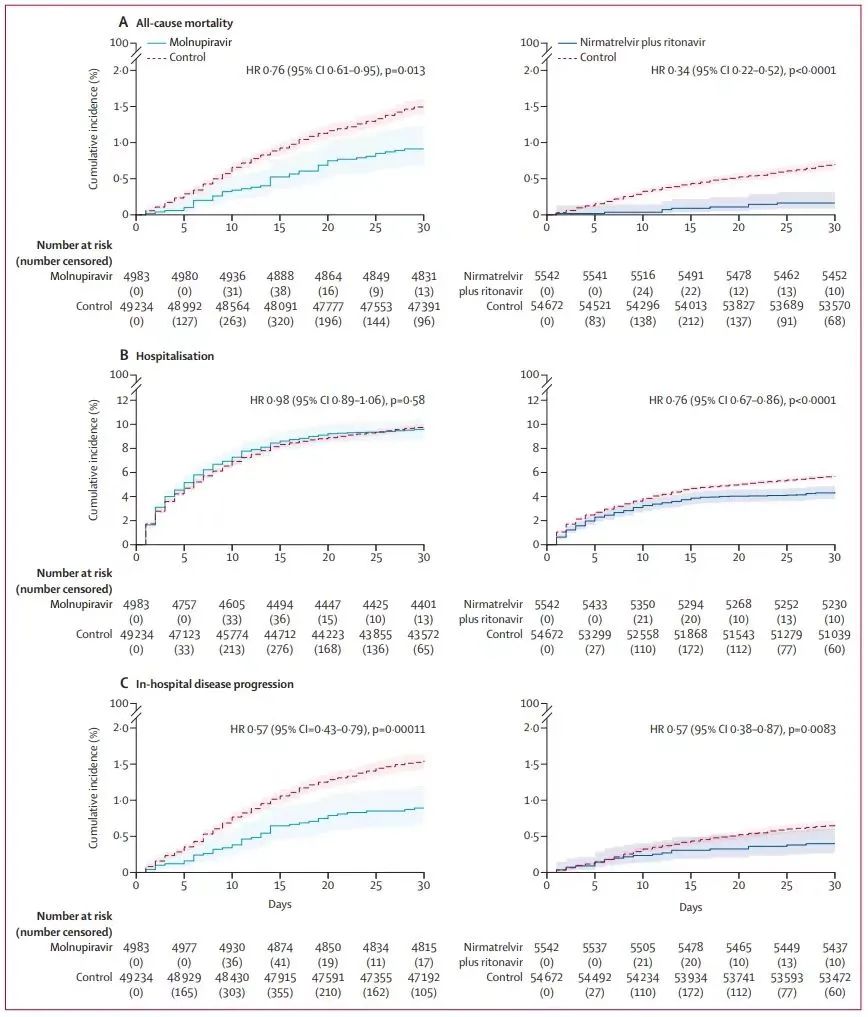
图2 研究过程(图源:《柳叶刀》)
而在2022年9月,最早一批获准使用Paxlovid的以色列,其最大医疗服务组织Clalit研究团队在NEJM发布了真实世界数据。

图3 研究成果(图源:NEJM)
研究发现,在符合条件、没有用药禁忌的约11万感染者中,真正接受Paxlovid治疗的仅3902人,占比不到4%,Paxlovid对40-65岁的人群几乎不起作用,只能减轻65岁以上老年人群的重症和住院死亡风险,Paxlovid降低65岁及以上老年人73%的住院风险或79%的死亡风险。
可以肯定的是,在降低老年人重症和住院死亡率方面,Paxlovid强于莫诺拉韦,强于任何药物,这是各种研究数据所给出的,但是在安全性和禁忌症方面,其表现不尽如人意。
我们先来看一下Paxlovid的成分。Paxlovid为奈玛特韦和利托那韦的组合药,二者不是混合的,而是分开的,颜色也不一样。其中,粉色药丸为奈玛特韦,是辉瑞专利产品,每一颗药含有效成分150mg,白色药丸利托那韦含有效成分100mg。
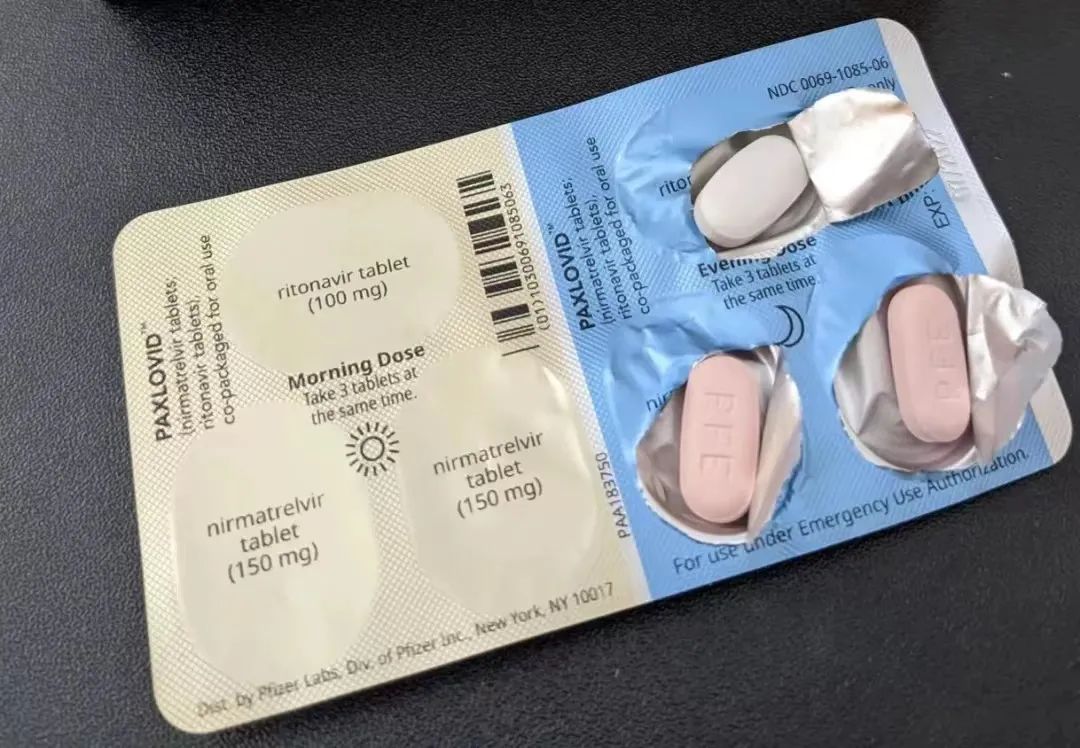
Paxlovid是口服药物,需整片吞服,不可咀嚼、掰开或压碎。推荐剂量为奈玛特韦300mg(150mg×2片)联用利托那韦100mg(100mg×1片),每12小时一次口服给药,连续服用5天。
奈玛特韦不能抑制病毒的复制,但是可以抑制病毒最后的组装。新冠病毒除了有遗传基因RNA外,还有与人体细胞接触的刺突蛋白、包裹RNA的核衣蛋白以及负责病毒组装和将病毒释放出细胞外的包膜蛋白、膜蛋白,共四种蛋白。
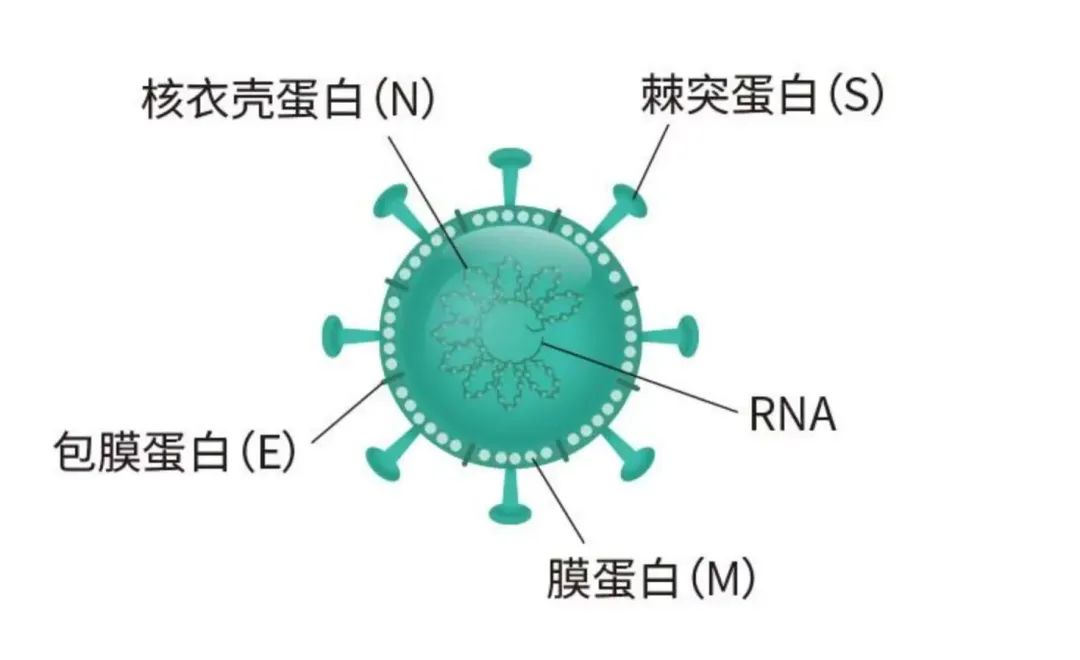
四种蛋白复制出来之后是连在一块的,需要3CL蛋白酶和PL蛋白酶把它们拆开和组装,它们才能发挥各自功能,其中3CL蛋白酶负责11个位点的切割。奈玛特韦则通过抑制3CL蛋白酶活性,阻止病毒生产出来的零部件完成最后组装。

但是,奈玛特韦进入人体后,很快就会被代谢掉,失去应有作用,人体内的代谢酶CYP3A,就负责奈玛特韦的代谢。这时,同时服用的白色药丸利托那韦,虽然跟抑制病毒并没有直接关系,但它可以抑制CYP3A代谢酶的活性,保证奈玛特韦不会那么快被代谢掉。
因此,服用两颗粉色奈玛特韦就需同时服用一颗白色利托那韦,以此确保血液中奈玛特韦的有效含量。然而,CYP3A代谢酶不仅代谢奈玛特韦,也代谢目前市场上50%的药物,服用Paxlovid组合药时,禁忌症特别多。

图4 以上药物不能与Paxlovid同时段服用(部分)

图5 以上药物需要在Paxlovid停用后至少2-3天才能使用(部分)
我们须知,Paxlovid主要对老年人起作用,而老年人由于患有基础疾病,平时肯定会规律服用各种药物,这样一来,合并其它药物使用的老年患者在选用Paxlovid就需格外小心。Paxlovid作为一种有严格禁忌症的处方药,未经高级医生充分评估,严禁个人自行服用!
另外,在临床试验中,Paxlovid常见的不良反应很多,包括味觉改变、腹泻、高血压、肌肉疼痛、腹痛、恶心等,因此不建议患有严重肝病和肾病的患者服用。
我们自己的国产药如何?
国人对阿兹夫定寄予厚望
辉瑞Paxlovid昂贵,且未进入医保,尽管其在降低重症和住院死亡等方面很明显,但还是有很多人非常排斥Paxlovid,他们总是在问,国产阿兹夫定的效果怎么样?科学研究进展如何?
阿兹夫定被称为我国“首个具有完全自主知识产权的口服小分子新冠病毒治疗药物”。2022年7月,河南真实生物科技有限公司宣布,阿兹夫定片治疗新型冠状病毒肺炎适应症注册Ⅲ期临床试验结果达到预期,正式向国家药品监督管理局提交上市申请。
7月25日,国家药监局附条件批准阿兹夫定片新增适应症,用于治疗普通型COVID-19成年患者。8月9日,国家卫生健康委办公厅、国家中医药局办公室发布通知,将阿兹夫定片纳入《新型冠状病毒肺炎诊疗方案(第九版)》,患者可在医师指导下严格按说明书用药。
阿兹夫定是一种广谱 RNA 病毒抑制剂,研发之初,其主要作为一种HIV病毒逆转录酶(RT)抑制剂而存在,属世界先进、国内首创的新一代治疗艾滋病药物。
后经发现,阿兹夫定作为一种病毒RNA聚合酶(RdRp)的核苷类似物,在细胞内代谢成具有抗病毒活性的5’-三磷酸盐代谢物(阿兹夫定三磷酸盐),同样能特异性作用于新冠病毒聚合酶(RdRp),其在新冠病毒 RNA合成过程中可以干扰逆转录,从而抑制新冠病毒复制,达到治疗新冠病毒感染的作用。
那么,阿兹夫定的临床研究结果是怎样的呢?在中华医学会第十七次全国传染病术会议和第14届中国医师协会感染科医师大会上,首都医科大学附属北京地坛医院张福杰教授对阿兹夫定的国内外临床研究进行了介绍。
张福杰教授称,目前阿兹夫定已在中国、俄罗斯、巴西开展过抗新冠病毒的全球临床试验。在我国进行的Ⅲ期研究由首都医科大学附属北京地坛医院牵头,是一项由全国11家中心参与的多中心、随机、双盲、安慰剂对照的临床试验,共纳入348例18~75岁轻型和普通型COVID-19患者,按照1:1随机分别给予阿兹夫定5mg,每日一次+基础治疗和安慰剂+基础治疗,试验方案治疗最多14天。
研究结果显示,阿兹夫定治疗后第5天,病毒载量下降显著高于对照组。在俄罗斯Ⅲ期临床研究中,共纳入了314例患者,观察第7天时症状改善的比例和时间。结果显示,试验组临床病情得到改善的比例显著高于对照组(40.43%与10.87%),达到临床优效结果,且临床状态改善时间显著低于对照组(10天vs 13天,p<0.001)。
而在巴西开展的临床研究共纳入了180例患者,结果显示,试验组受试者最终临床状态改善比例显著高于对照组受试者,且核酸转阴时间、住院时间均显著低于对照组受试者。
但是,作为目前国产最为出名的新冠口服药,阿兹夫定也一直饱受争议,吐糟最多的便是其Ⅲ期临床研究尚未在学术期刊上正式发表、其研究数据未在大规模人群中开展,其可能的肝脏毒性、肌酸激酶升高、线粒体毒性(如肌肉损伤情况、乳酸脱氢酶升高)等尚未在新版说明书中揭示。
根据《新冠诊疗方案(试行第十版)》内容,共识不建议在妊娠期和哺乳期使用阿兹夫定,中重度肝、肾功能损伤患者慎用。因此,国人对阿兹夫定的美好期待,仍需更多研究数据和研究细节公布出来,并加以支撑。
NEJM公布了VV116三期临床数据,
疗效不劣于Paxlovid?
VV116是中国科学院上海药物研究所、中国科学院武汉病毒研究所、旺山旺水生物医药有限公司等多家机构联合开发的一款新型口服核苷类抗SARS-CoV-2药物,通过靶向RNA依赖的RNA聚合酶(RdRp)抑制病毒RNA的合成。
2021年9月,君实生物与旺山旺水达成合作协议,共同承担VV116在全球范围内的临床开发和产业化工作。2021年12月30日,VV116在乌兹别克斯坦获得紧急使用授权。研究表明,VV116对Alpha、Beta、Delta和Omicron均表现出抗病毒活性,同时具有很高的口服生物利用度和良好的化学稳定性。
正因为如此,在2022年4月19日,据中国临床试验注册中心显示,苏州旺山旺水生物医药登记了一项评价JT001(VV116)对比辉瑞Paxlovid早期治疗轻-中度新型冠状病毒肺炎(COVID-19)有效性和安全性的多中心、单盲、随机、对照III期临床研究。
这是一项头对头的三期对比试验,如果没有足够的证据和数据表明VV116在抑制病毒复制方面足够有效,那么,这项研究是不敢轻易去做的。最终的研究结果是怎样的呢?12月29日,顶级期刊NEJM公布了这项研究的数据。

图6 研究成果(图源:NEJM)
这项研究完成于上海 3~5 月份由 Omicron 变异株(B.1.1.529)引起的疫情爆发期间,旨在评价 VV116 对比 Paxlovid 用于轻中度 COVID-19 患者早期治疗的有效性和安全性。
研究人员对来自中国上海 7 家医院的参与者进行了资格评估,采取多中心、观察员设盲、随机、对照试验,选取了进展风险高、且具有轻度至中度症状的 822 名 Covid-19 成人患者参与试验分组。
最终,有 771 名参与者接受了口服药物治疗的试验。其中384 名为VV116研究组,第 1 天每 12 小时 服用600 mg,第 2~5 天每 12 小时服用300 mg;387 名为Paxovid组,服用300 mg 奈玛特韦 + 100 mg 利托那韦,每 12 小时一次,持续 5 天。
该临床研究结果显示,VV116 用于轻中度 COVID-19 的早期治疗达到临床方案预设的主要终点(至持续临床恢复的时间):VV116 组临床恢复的中位时间为 4 天,Paxlovid 组的临床恢复的中位时间为 5 天(风险比,1.17;95% CI,1.02~1.36;下限,>0.8)。在每一个预设时间点(第5、7、10、14、28天),VV116组症状缓解的患者比例,均高于Paxlovid组。两组患者均未发生进展为重度/危重COVID-19(新冠)或死亡。
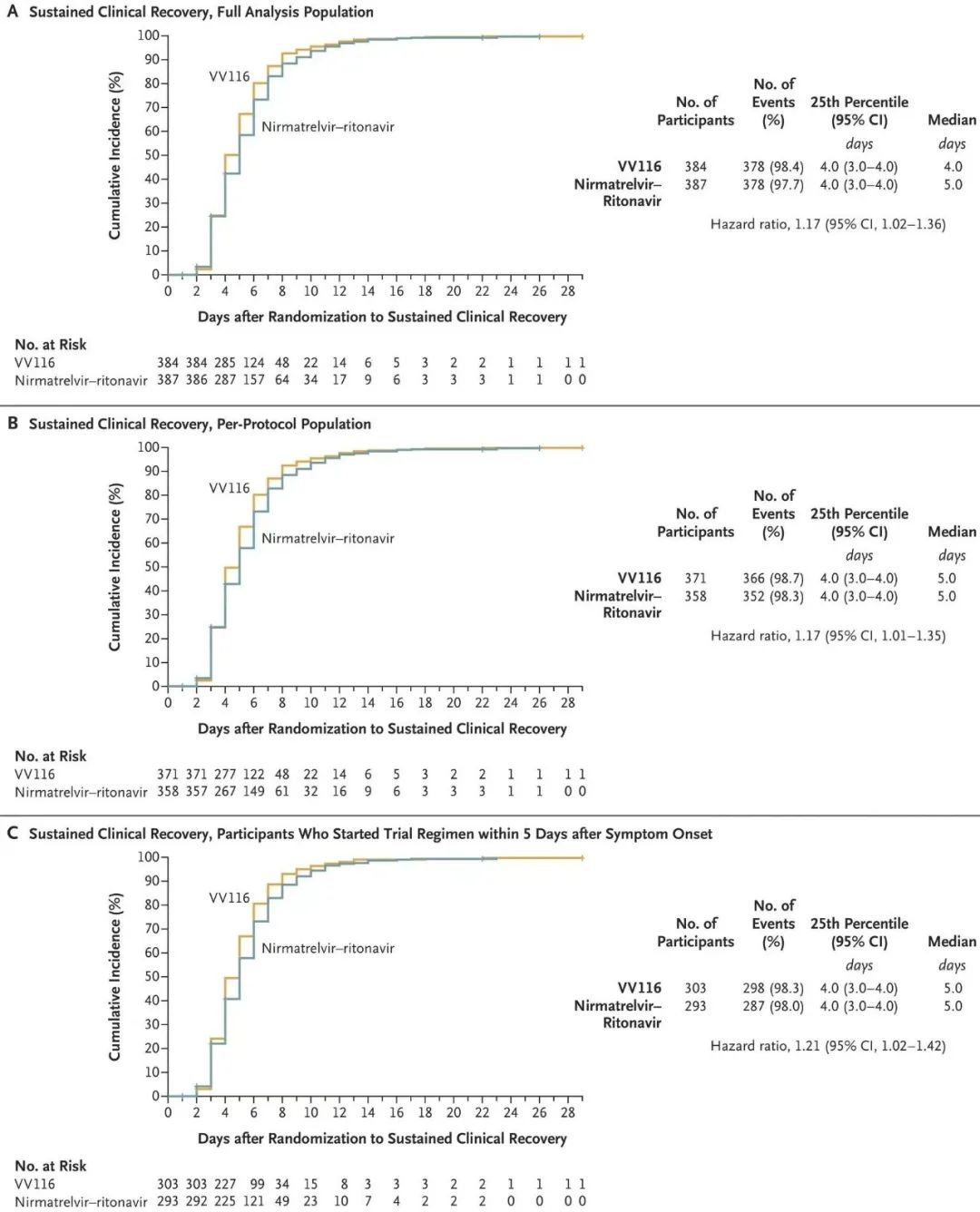
图7 至持续临床恢复的时间(图源:NEJM)
在安全性方面,通过 28 天的随访,接受 VV116 的参与者报告的不良事件(67.4%)少于接受 Paxlovid 的参与者(77.3%),而对于 3 级/ 4 级不良事件的发生率,VV116 的报告数(2.6%)也低于 Paxlovid(5.7%)。

图8 不良事件发生率(图源:NEJM)
以上结果显示,VV116的治疗效果是不劣于Paxlovid的,但随后,也有人表示质疑。例如,本来这次Ⅲ期临床试验最初设置了两个主要终点,分别是患者“转重症”和“症状恢复” 的时间,而在试验中,研究人员放弃了“双终点”,仅探索了患者的持续症状恢复时间。
为什么要删除“进展为重度/危重COVID-19或全因死亡的受试者百分比”这一临床研究终点?是因为不自信从而导致的心虚吗?
对此,研究人员回应称,这是因为上海疫情期间,试验执行过程中发现奥密克戎致病性下降,导致重症事件发生概率极低,研究人员只能放弃“重症”这一实验指标。而也正如所预期的那样,结果表明两组(VV116和Paxlovid)进展为重型的受试者人数为0。
有些人总是持有非此即彼的观念,总要比较不同新冠治疗药物的好坏,单纯认为,哪种药疗效好,就用哪一种,哪种不好就坚决不用。
事实上,这三种治疗药物抗新冠病毒的作用机制不同,并非是你死我活的斗争状态,理论上或许可以互相组合、互相协作,起到更好更强的治疗效果。
因此,我们的争论不应该是哪种药物更好,可以相信,这些药物都有一定的疗效,目前我们最缺的是更多更全面关于药物有效性、安全性方面的临床研究和数据,不只是阿兹夫定和VV116,即使是Paxlovid,这方面的数据和循证医学证据也是远远不够的!