本文转载自“新药前沿”微信公众号
到今年底,至少应有15种靶向降解剂(从异源双功能蛋白裂解靶向嵌合体(PROTAC)到分子胶)进入到临床试验阶段。
传统的药物研发策略关注如何通过直接调控蛋白质或酶的活性来治疗疾病。因此,蛋白质活性调节剂,特别是抑制剂的开发和应用一直是药物研发的主流方向。然而,传统的小分子和抗体药物只能靶向大约20%的蛋白,而最近新出现的降解技术则有可能破解其余80%的蛋白质组。
靶向蛋白降解是继蛋白激酶抑制剂和单克隆抗体之后,药物研发领域又一新兴方向和策略,为疑难疾病治疗药物的研发开辟了新的途径。
小分子降解剂通过介导泛素化连接酶与靶蛋白的识别,对靶蛋白进行降解。目前蛋白降解剂主要有两类,一类是PROTAC,通过泛素-蛋白酶体途径特异性地降解靶蛋白。另一类是分子胶,也是通过结合泛素化连接酶,但与PROTAC不同的是,分子胶是通过修饰泛素化连接酶表面,从而识别并降解全新底物。
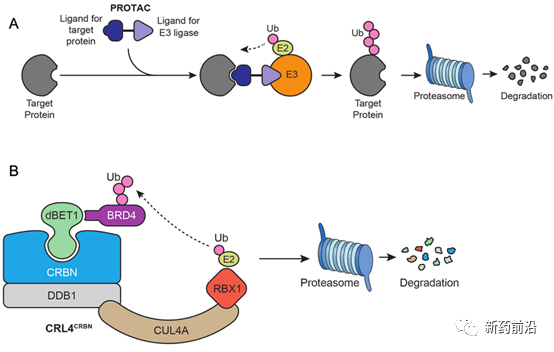
现在,许多大型制药公司都在投资靶向蛋白降解剂这些小分子。数十家生物技术公司都在拥抱这项新技术。学术团体也正在制备可用于临床的降解剂。一个PROTAC跟踪数据库现在列出了1600多个公开披露的异源功能降解剂,可作用于100多个靶点。
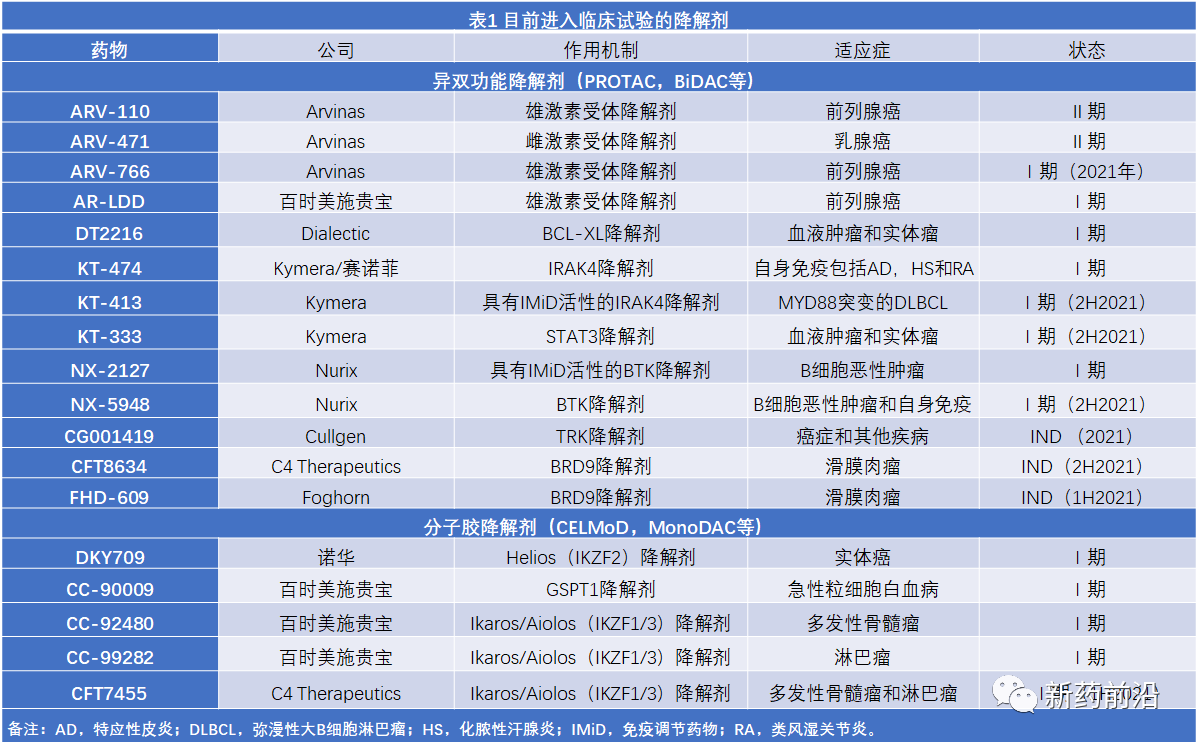
目前,已有多种靶向蛋白降解剂进入到临床试验阶段,与此同时,制药公司正在努力把临床前的多个项目推进到临床。除一个项目外,其他所有项目适应症都在癌症。许多药物都具有经过验证的治疗实用性,可降解靶点,其疗效,安全性和商业风险经过了解。但是有些开发者也正在对其他新的靶点进行研究(表1)。
01 降低靶点选择风险
2013年成立的Arvinas是最早进入降解剂领域的公司之一。因此,降低靶点选择风险是确定项目优先级的关键。雄激素受体(AR)是Arvinas重点研究的靶点之一。预防AR信号传导的抗雄激素疗法包括1989年首次上市的氟他胺,以及安斯泰来2012年获批现在年销售额达到30亿美元的恩杂鲁胺。
Arvinas开发主要AR降解剂ARV-110是于2019年第一种进入临床试验的异双功能靶向降解剂。迄今为止的数据表明,ARV-110作为口服生物可利用的降解剂是安全的,这对于任何首创的新疗法都是成功的。ARV-110在治疗转移性去势抵抗性前列腺癌(mCRPC)患者的Ⅰ/Ⅱ期临床试验中,对于携带特定基因突变的患者群,可将40%患者的前列腺特异性抗原(PSA)水平降低50%以上。初始临床研究显示,一名患者的活检数据显示AR下降70-90%。
Arvinas开发靶向降解雌激素受体(ER)ARV-471能够显著降低患者肿瘤组织中的ER表达水平,平均将ER水平降低62%,最多降低接近90%。而且,ARV-471对野生型ER和ER突变体均表现出降解效果。
Arvinas于4月在美国癌症研究协会(AACR)上公开ARV-110及ARV-471的结构。
Nurix Therapeutics开发的NX-2127(一种B细胞发育激酶BTK降解剂)采取了另一种经过充分验证的靶点。选择BTK靶点也是Nurix公司降低药物开发风险的关键。强生公司于2013年获批BTK抑制剂依鲁替尼,用于多种血液癌的治疗,在2020年获得了76亿美元的收入。
首先,新一代BTK抑制剂的研究工作表明,更好的靶点选择性可带来更好的安全性。因此,Nurix可以探索其降解剂选择性优于现有BTK抑制剂的效果。其次,尽管患者会通过靶点活性位点的突变而对批准的BTK抑制剂产生抗药性,但NX-2127具有针对BTK最常见的活性位点抗药性突变的临床前活性。与竞争产品相比,Nurix认为其BTK降解剂可能会延迟抗药性的出现。NX-2127于2月份获美国FDA批准进行临床试验。
值得一提的是,4月6日,我国海思科公司发布公告称:其子公司四川海思科自主开发的HSK29116散剂的临床试验申请已获得CDE默认许可,用于治疗复发难治B细胞淋巴瘤。这对于国内PROTAC技术发展具有里程碑的意义,因为它是国内首个获批临床的BTK-PROTAC,也是全球继NX-2127之后第二个。
02 First-in-class正在开启
其他异源双功能项目在新靶点选择方面在过去几年经历了比较困难的时期。
降解剂的主要卖点是其驱动破坏具有多种功能蛋白质的能力。具有催化活性位点的蛋白(包括激酶)也可以用作支架蛋白(带有多个蛋白质结合域可把信号转导途径中与该途径相关的蛋白质组织成群的蛋白质),例如将蛋白复合物保持在一起。多年来,这种功能阻碍了许多药物开发计划。
以IRAK4为例,该激酶可同时激活IL-1家族受体和Toll样受体(TLR)炎症信号。尽管与关节炎,动脉粥样硬化,阿尔茨海默病,痛风,系统性红斑狼疮,银屑病等有关,但药物开发者最近才以靶向IRAK4的小分子取得进展。IRAK4抑制剂为何开发滞后的一种可能解释是,该蛋白具有支架功能,可将Myddosome复合物结合在一起,并即使其激酶功能受阻也可促进下游炎症信号传导。
迄今为止,Kymera开发的KT-474是临床上唯一的非肿瘤降解剂,其开发的适应症包括特应性皮炎和化脓性汗腺炎。Kymera的KT-413是具有免疫调节剂(IMiD)活性的IRAK4降解剂,将于今年晚些时候进行癌症适应症临床试验。
同时,C4 Therapeutics有一个靶向BRD9(溴结构域蛋白家族成员)的项目CFT8634。含溴结构域的蛋白质识别组蛋白和其他蛋白质上的乙酰化赖氨酸。在过去的十年中,该靶点具有可成药性和一系列生物学功能,而引起了业界的广泛关注。而且,新的研究数据表明,BRD9在罕见类型肉瘤中起关键作用,可能由支架功能驱动。不过,BRD9确切的生物学功能仍在研究中。2018年的一项研究分析表明,BRD9是异常染色质重塑复合体的一个组成部分,被认为是滑膜肉瘤的主要驱动因素。至关重要的是,在滑膜肉瘤疾病的小鼠模型中,BRD9的降解阻止了肿瘤的进展。
凭借其BRD9降解剂CFT8634,C4 Therapeutics也看到了一条清晰的开发路径。滑膜肉瘤是一种致命的癌症,主要影响青少年和年轻人,目前治疗选择有限。滑膜肉瘤是由染色体易位驱动的,易位的致癌能力似乎取决于BRD9。
C4 Therapeutics计划于今年晚些时候提交一项研究性新药申请,以开始对CFT8634进行Ⅰ期试验。目前还没有BRD9抑制剂进入到临床试验中。
03 分子胶降解剂尝试突破
大多数小分子依靠配体与蛋白质的相互作用来获得活性,而分子胶降解剂是通过调节蛋白质与蛋白质的界面来捕获其靶点。Ikaros和Aiolos都是锌指转录因子,由于缺乏催化活性位点而难以用小分子进行药物治疗的靶点。分子胶降解剂就可以作用于新的靶点,包括异双功能降解剂无法达到的靶点。
诺华公司已经发现并开发了一种胶降解剂,该胶降解剂与另一个锌指转录因子Helios结合。该降解剂DKY709作为单一疗法,以及与诺华的抗PD1 PDR001联合使用正在进行晚期实体瘤的Ⅰ期试验。
百时美施贵宝的鸟苷三磷酸酶GSPT1降解剂CC-90009证明,胶降解剂也可以作用于其他种类的蛋白质。CC-90009以最大程度地降解GSPT1,并最大程度降低Ikaros,Aiolos和其他与毒性相关的新底物的降解。最近在《血液》杂志中报道,CC-90009还杀死了急性髓细胞白血病胚细胞和白血病干细胞。