
本文转载自“澎湃新闻”,原标题为:中国动物疾病模型重大进展:首例亨廷顿舞蹈病基因敲入猪诞生。
1872年,亨廷顿病由美国医学家乔治•亨廷顿首次发现并因此命名。患病者会表现出手舞足蹈状,故又被称为“致命的舞蹈”。
实际上,类似于阿尔茨海默症(AD)、帕金森综合征(PD)、肌萎缩性脊髓侧索硬化症(ASL)等,亨廷顿病是一种神经退行性疾病。但和阿尔茨海默症等疾病不同的是,亨廷顿病还是一种常染色体显性遗传疾病。这就意味着,只要父母一方患有疾病,子女就有50%的概率面临相同的命运,甚至世世代代难以逃脱“魔咒”。
目前,该疾病没有有效治疗方法,“看着他走向死亡”是患者家属的最后心路。过去的20年时间里,药企进行了近百次临床试验,研究了治疗亨廷顿症的41种不同组合药物,但只有2种药物获得许可,并且只能缓解症状。
最新的进展是,该疾病的大动物模型成功建立。北京时间3月30日,生物学顶级学术期刊《细胞》(Cell)在线发表了中国科学家的一项重大成果:首次利用CRISPR/Cas9基因编辑技术和体细胞核移植技术(SCNT),成功培育出世界首例亨廷顿舞蹈病基因敲入猪,精准地模拟出人类神经退行性疾病。2个月以前,中国科学家获得全球首个体细胞克隆猴的成果也发表在该期刊。
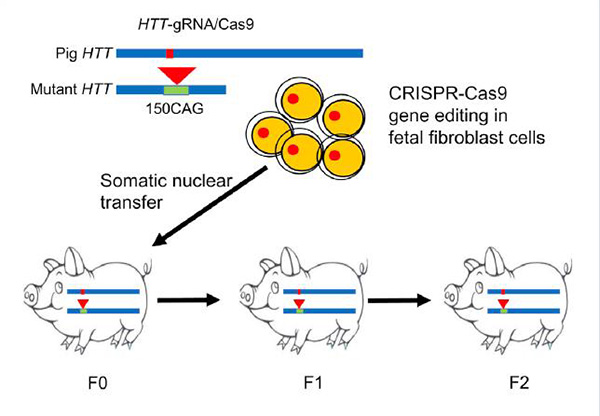
利用基因编辑技术(CRISPR/Cas9)等培育出世界首例亨廷顿舞蹈病基因敲入猪
论文共同通讯作者为暨南大学粤港澳中枢神经再生研究院李晓江教授、中国科学院广州生物医药与健康研究院赖良学研究员、美国埃默里大学李世华教授。李晓江是亨廷顿病研究领域的权威,于2008年和李世华在世界上首次利用转基因的方法建立了非人灵长类的亨廷顿疾病猴模型。赖良学则长期从事猪等大型哺乳动物的克隆,2010年和李晓江、李世华合作建立了首例转基因亨廷顿舞蹈病的猪模型。
赖良学在接受澎湃新闻(www.thepaper.cn)采访时表示,“过去长期存在的问题是,我们用转基因克隆技术试图建立亨廷顿病的大动物模型,但转基因的缺点是基因插入位置无法控制、表达量也无法控制,因此此前转基因克隆获得的猪或者猴子都存活不了几天,准确来说无法称之为模型。”
赖良学提到,2013年CRISPR/Cas9基因编辑技术的问世,让这项亨廷顿病动物模型的研究工作出现曙光。研究团队再次投入了长达4年的时间,最终获得这份成果。
著名的细胞生物学家、原同济大学校长、中科院院士裴钢表示,2008年,我们在制定发育与生殖研究国家重大科学研究计划"十二五"专项规划时,就前瞻性地布局了大型实验动物模型包括猪和猴的培育内容,并在后来的“干细胞国家重大科学研究计划”中持续加大经费投入。
裴钢评价,我国在基因编辑猴和克隆猴的研究中相继取得突破性成果,这次我国科学家在猪的疾病模型研究中又取得重大进展,表明我国在大动物模型的研究中已走在世界前列,将极大地推动我国生物医药产业的创新发展。
从事多年亨廷顿病研究的权威专家、美国加州大学洛杉矶分校杨向东教授也指出,亨廷顿舞蹈病基因敲入猪的建立是神经退行性疾病研究领域中的一个里程碑式的发现,使科学家能更深入了解神经细胞死亡的机制及寻找有效的治疗方法。
定点敲入人致病基因
亨廷顿病的病因是,患者体内的亨廷顿基因外显子1发生了CAG三核苷酸重复突变,进而引发其编码的亨廷顿蛋白(HTT)多聚谷氨酰胺(polyQ)序列延长所致。实际上,除亨廷顿病之外,多聚谷氨酰胺序列延长还会导致其他至少8种神经退行性疾病,包括脊髓小脑共济失调、脊髓延髓肌肉萎缩症(肯尼迪病)等。
值得一提的是,亨廷顿病是由单基因突变导致的神经退性疾病,这使之成为一个理想的疾病模式,可用于研究蛋白质错误折叠如何引起选择性的神经退性病变,也是以后研究多基因突变病症的基础。
研究团队利用CRISPR/Cas9基因编辑技术将人突变的亨廷顿基因,即人外显子1中包含150 CAG重复序列精确地插入猪的亨廷顿蛋白内源性基因中。研究团队通过PCR筛选了2430个融水胎儿猪成纤维细胞,最终确定了9个阳性克隆细胞。
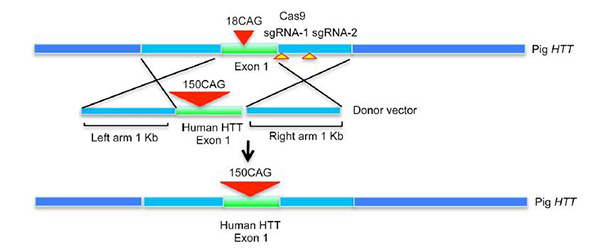
研究团队挑选了其中一个细胞克隆株用于体细胞核移植,最终获得2880个胚胎。这些胚胎被转移至16头代孕猪,其中10头代孕猪怀孕成功,排除流产后获得了7头自然产下的小猪。
PCR基因型分析和DNA测序结果显示,共有6头猪携带了扩展CAG重复的人类亨廷顿蛋白外显子1。这6头猪即被称为F0代。
随后,研究团队用F0代母猪和野生型公巴马香猪交配,获得F1代猪。F1代公猪和野生型母巴马香猪交配,获得F2代猪。论文中数据显示,过去的两年时间里,研究团队通过这种繁殖方式,获得了15头F1代猪和10头F2代猪,全都呈现突变亨廷顿蛋白阳性。
赖良学告诉澎湃新闻,“论文发表之后,还在继续产生后代,现在所有的基因敲入猪加起来,差不多有近50头了。”
赖良学强调,“以前用转基因技术将外源基因转进去之后,猪本身的亨廷顿蛋白也在同时起作用,这次通过基因编辑敲入,猪本身基因是破坏掉的。这样,猪本身的亨廷顿基因就不会表达了,纯粹表达人致病基因。结果出来的症状、病理变化都是跟自然发生的是一致的。”
症状、病理与人类似
亨廷顿病主要特点是躯体和四肢不可控制地舞蹈样运动,渐进性认知能力下降和精神障碍,主要病理特征则为大脑纹状体区中型棘突神经元(MSN)逐渐丢失。
论文中数据提到,截至论文最终版本,年龄最大的F0代为30个月,最大的F1是12个月,F2代则还是新生猪。因此,研究团队研究焦点主要放在F0代和F1代。
研究团队首先要确定,致病基因有没有让这些基因敲入猪表现出和人一致的年龄相关的神经学症状,并且这些症状是否遗传给后代。
一般来说,亨廷顿病患者发病多在35岁到50岁,表现为舞蹈样症状、认知和精神障碍。患者生命持续约10到20年,甚至有2-3年即去世的病例。令人惋惜的是,亨廷顿病发病时间一般已超过生育年龄,且为显性遗传,因此大多数患者都在发病前已“悄然”遗传给下一代。
赖良学提到,“除非采用基因检测,否则很难在没有发病前意识到自己患病。”
研究结果显示,基因敲入猪在4个月以前没有表现出明显症状,和同性别、同年龄野生型猪相比,体重增加也很少。
年龄较大的基因敲入猪皮肤则会有严重的褶皱和下垂。一些F0代基因敲入猪在5个月和10个月之间会过早死亡,也通常表现出走路畸形。这些症状都和人类相似。

赖良学介绍,“4个月以后,运动能力就开始受到一定的影响,正常走可能看不出来,但放到跑步机上,让它使劲跑,它跑着跑着就不行,比正常的猪运动能力差。”论文中提到,用跑步机来观察F0代猪的运动功能,结果显示,一头5个月大已经表现出症状的基因敲入猪无法和正常对照组一样运动,其他F0代猪也表现出类似的跑步困难。
值得一提的是,这头5个月大的基因敲入猪在跑步机测试2天后即死亡了。研究团队认为,这一点或许说明基因敲入猪难以承受运动负荷,呼吸衰竭可能是这头猪死亡的直接原因。
而肺功能障碍和吸入性肺炎或窒息也可能是亨廷顿患者的主要死因。
另外,基因敲入猪表现出呼吸困难或者呼吸不规律。目前,呼吸困难只在基因敲入猪身上表现出来,此前在小鼠和其他动物模型上均未看到。
除症状之外,这些基因敲入猪的大脑区域选择性神经病理学也和人类相似。病理学分析显示,5个月大基因敲入猪大脑尺寸比同龄的野生型猪要小,大脑皮层的厚度和纹状体的尺寸也更小。对5个月大的已有症状的基因敲入猪进行MRI(核磁共振成像)分析也显示出,它们的侧脑室扩大、纹状体尺寸则减小。
另外,163个临床案例显示,相比壳核,纹状体的尾状核会提前发生退化。而5个月大的有症状的基因敲入猪的纹状体也表现出一致的退化顺序。
代代相传、多因素决定能活多久
值得一提的是,此前研究团队用转基因试图建立的猴模型、猪模型,皆因表达外源性致病基因片段的毒性过强,出生不久后即死亡。而研究团队此番成果的重要性之一就在于实现了传代。
研究结果显示,F1代在基因表达、体重增加、早期死亡、运动困难、呼吸困难等方面都和F0代类似。这意味着,发生在亨廷顿病患者身上的“遗传性”在基因敲入猪模型上也同样实现。
赖良学表示,“和人一样,这些猪也可以发育到性成熟(猪性成熟在5-6个月),可以有后代。2010年我们发过的文章是用转基因猪,它的症状就太明显了,表达量太高,所以生下来几天就死了。李晓江教授在美国用的转基因猴也一样,也没活下去。没活下来就没有用,并没有形成这个动物模型。”
不过有趣的是,基因型分析显示,CAG重复并不稳定。实验结果得出,在F0代中是130-150 CAGs,F1代是113-206 CAGs,F2代是118-230 CAGs。另外,在不同组织中CAG重复也是不一致的。
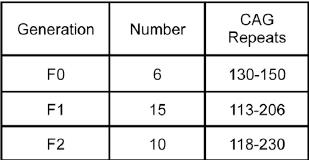
赖良学认为,这或许是造成个体之间发病时间不一样、发病轻重也不一样的原因。
论文中还提到一个注意点,一头含有206 CAGs的基因敲入猪比其它含有113-138 CAGs的几头猪寿命要长,这就暗示CAG重复长度并不是生命长短的唯一决定因素。
研究团队指出,环境压力以及其他因素同样能影响这些猪最终能活多久。
研究也确实发现,对F1代的基因敲除猪采用“单间”饲养,也就是帮助它们减少环境压力后,它们的寿命比F0代这些“群体”饲养的基因敲除猪要长。
值得一提的是,该项研究之所以被视为神经退行性疾病研究领域中的一个里程碑式的发现,关键一点还在于此前经常使用的模型为小鼠等啮齿类动物,而种间差异实际上是一道很大的研究鸿沟。
论文中指出,尽管亨廷顿症小鼠模型在突变亨廷顿蛋白方面表现出和年龄相关的累积,以及其他一些神经学症状,但基因敲入亨廷顿小鼠缺乏明显的神经退行性,而这正是亨廷顿病经典的病理学标记。
当然,和非人灵长类动物模型相比,猪和人类要远一些。但猪模型的明显优势在于,繁殖周期快(5-6个月即能性成熟)、一胎产仔量大(平均7-8头小猪)。赖良学举例表示,“以后也可以用类似的方法建立猴子模型,但通过猴子模型观察和年龄相关的神经退行性症状,以及利用它传代再观察后代,这将是一个很长的周期。”







