近日,港股创新药企云顶新耀(HKEX 1952.HK)第三款商业化产品伊曲莫德(VELSIPITY®)在获批进入粤港澳大湾区之后,在临床研究方面又迎来重大进展,其最新研究数据在世界权威学术会议上公布并获得关注。
据悉,伊曲莫德作为云顶新耀自体免疫领域的重磅产品,用于治疗中重度活动性溃疡性结肠炎(UC)的亚洲多中心Ⅲ期临床研究ES101002的完整诱导期数据,已在第32届欧洲消化疾病周(UEGW 2024)这一全球消化系统疾病领域的顶级学术会议上以口头报告的形式进行了呈现。
云顶新耀首席执行官罗永庆表示,很高兴看到伊曲莫德的完整诱导期研究数据取得具有临床意义和统计学显著性的积极结果。“在‘港澳药械通’政策支持下,伊曲莫德正式获得‘粤港澳大湾区内地临床急需进口港澳药品批件’批准,进入大湾区,成为云顶新耀第三款商业化新药。今年我们将在中国大陆地区递交伊曲莫德的新药上市许可申请,扩大可及性,造福更多患者。”
据了解,伊曲莫德已在中国澳门和新加坡获得新药上市批准,并在中国香港已递交了新药上市许可申请。近期,通过“港澳药械通”政策,伊曲莫德在大湾区顺利落地,并在中山大学附属第一医院和佛山复星禅诚医院这两家大湾区药械通政策指定的医疗机构中先行使用,为内地患者带来了新的治疗希望。云顶新耀在商业化方面进展迅速,现已推动三款创新药顺利上市,其中包括全球首个IgA肾病对因治疗药物耐赋康®、全球首个氟环素类抗菌药物依嘉®以及伊曲莫德。
伊曲莫德亚洲临床结果表明显著改善
百万国内患者有望迎来新治疗选择
溃疡性结肠炎作为一种慢性、复发性、非特异性炎症性肠病,因其发病机制复杂且治疗难度大,导致患者致残率和结直肠癌发生率随着病程延长而不断攀升,治疗负担日益沉重。据预测,至2030年,中国溃疡性结肠炎患者人数将较2019年翻番,达到约100万人,因此,创新疗法的出现显得尤为迫切。
伊曲莫德于去年10月和今年2月先后在美国和欧盟获得新药上市批准,成为欧盟首个且唯一获批用于16岁及以上患者的新一代口服治疗溃疡性结肠炎药物,也是目前唯一在全球Ⅲ期临床试验中证实对孤立性直肠炎有疗效的药物。
ES101002研究是一项在亚洲地区开展的伊曲莫德的多中心、随机、双盲、安慰剂对照III期研究,是迄今为止完成的最大规模的亚洲中重度溃疡性结肠炎的III期注册临床研究,总计 340名中重度活动性溃疡性结肠炎患者随机接受伊曲莫德或安慰剂治疗。在12周诱导治疗期内,既往对至少一种常规治疗、生物制剂或Janus激酶(JAK)抑制剂治疗失败或不耐受的溃疡性结肠炎患者,每日一次服用2mg伊曲莫德或安慰剂治疗。
伊曲莫德亚太临床试验牵头研究者、世界胃肠病学会常务理事、亚太消化病学会秘书长兼常务理事、中华医学会消化病学分会副主任委员、中国人民解放军第四军医大学附属西京医院吴开春教授表示:“ES101002研究的分析结果表明,与安慰剂相比,患者接受伊曲莫德2mg治疗显示出更大改善,这种新一代S1P调节剂通过口服、每日一次的治疗方案,可快速起效,达到临床缓解,并显示其对于深度愈合的积极作用,显著提高了内镜恢复正常和粘膜愈合的患者比例。此次完整积极数据的公布,再次在循证证据上证明伊曲莫德治疗中重度活动性溃疡性结肠炎具有良好的疗效和安全性,相信伊曲莫德可以为更多患者带来新希望。”
诱导期研究结果的完整数据显示,伊曲莫德治疗组的所有主要和关键次要疗效目标均达到具有统计学意义和临床显著性的改善:与安慰剂组相比的临床缓解率、内镜改善率和临床应答率的治疗差异分别达到 20.4%、28.6%和32.0% ( P值均<0.0001)。深度愈合与疾病的长期控制、减少复发、降低并发症和以及提高生活治疗密切相关。接受伊曲莫德治疗的患者在粘膜愈合(P<0.0001)和内镜恢复正常(P=0.0003)方面均达到了具有临床意义和统计学显著性的改善。
此外,ES101002研究的维持期顶线结果已于今年7月发布。经过维持期治疗后,与安慰剂组相比,伊曲莫德组同样达到了主要和所有次要疗效终点 (P均<0.0001)。维持期研究结果的详细数据计划在近期的学术会议上进行公布。
云顶新耀着眼全球市场布局
蓝海领域下核心产品商业化提速 爆发期已至
近年来,云顶新耀驶入发展快车道,依托双轮驱动模式,聚焦肾病、重症抗感染、自体免疫、肿瘤治疗性疫苗等“蓝海“领域,高效创立行业最佳商业化实践,一方面高效精干地推动产品商业化进程,快速提升收入、运营效率及利润,另一方面基于全球医疗市场需求来聚焦开发具有自主知识产权的突破性项目。
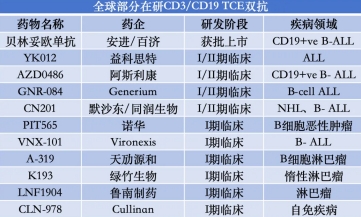
云顶新耀立足于全球视野,布局了当下热门的BTK抑制剂方向,拥有全球权益的EVER001是一款新一代共价可逆的布鲁顿酪氨酸激酶(BTK)抑制剂, EVER001凭借其卓越的分子设计,采用了共价可逆的创新思路,非常适用于自身免疫适应症的开发,仅在中国市场,该药物潜在的患者规模就高达200万,而在全球范围内BTK抑制剂市场规模正以22.7%的复合年增长率增长。同时,在云顶新耀的自研产品线中,公司的mRNA平台也展现出了强大的竞争力,不仅拥有自主知识产权,还经过了严格的临床验证,在肿瘤mRNA疫苗、自身免疫等多个领域都具备明显优势。
近期,伊曲莫德亚洲临床研究的积极数据的持续公布,并在粤港澳大湾区获得批准使用,预示着该产品在国内的市场潜力即将得到充分释放,有望成为云顶新耀新的重要收入来源。罗永庆表示,云顶新耀对实现全年人民币7亿元的销售目标非常有信心,并力争在2025年底前实现现金盈亏平衡的战略目标。
根据2024年中报数据,得益于耐赋康®及依嘉®的出色市场表现,云顶新耀在上半年取得了重大的商业化成果,公司总收入达到人民币3.02亿元,较2023年下半年大幅增长158%,并首次实现了商业化层面的盈利。国家医保局近日已于官方网站宣布2024年国家医保药品目录调整现场谈判已经顺利结束,云顶新耀作为新兴生物医药企业的代表位列谈判企业。
两个月以来,云顶新耀股价累计涨幅超过80%,市值已突破100亿元大关,在一众创新药企业中表现亮眼。随着云顶新耀步入稳定的商业回报期,多家证券公司推荐买入和坚定持有,这些都表明资本市场对云顶新耀的战略决策和商业化成绩的认可。凭借耐赋康®、依嘉®和伊曲莫德等创新药物的强劲表现,以及在临床开发和注册上市方面的优势,将推动云顶新耀获得长期的商业化回报。