肉毒素作为一种神经毒素,被广泛应用于除皱、塑形等医美领域,以及神经、康复、泌尿等临床治疗领域,且适应症仍在不断探索扩大中。根据ISAPS发布的Global Survey 2023数据,2023年全球共进行肉毒素注射约888万例,占非手术医美的46.3%,位居医美非外科手术处理类榜首。
目前,全球上市的肉毒素产品主要为天然A型肉毒素,市场主要被BOTOX®、Dysport®、XEOMIN®、Letybo®、NABOTA®、衡力®等几大产品占据。随着重组蛋白技术的发展,经过肉毒素领域科学家和研发专家多年探索,重组A型肉毒素开发获得成功并已推进到临床。重组A型肉毒素凭借其高纯度、低生物风险、低免疫风险、高生产效率、低成本等优势,有望带领肉毒素行业进入新时代。
肉毒素市场较为集中,产品创新发展加速
目前全球肉毒素市场集中,呈现寡头状况
早在上个世纪,肉毒素已在斜视、眼睑痉挛、除皱等应用领域进行治疗探索。1989年,美国FDA批准了肉毒素用于治疗眼睑痉挛和斜视;2002年,美国FDA批准了全球首个A型肉毒素产品——BOTOX®,用于改善中至重度眉间纹。目前,全球范围内已有超10款天然肉毒素产品上市。
天然肉毒素由肉毒杆菌发酵产生,其品质高度依赖于肉毒杆菌菌株的特性,同时由于活的肉毒杆菌具有高生物风险,相关生产在大部分国家受到限制甚至禁止,且生产设施投资成本高昂,再加之天然肉毒素的生产工艺复杂、产量有限等局限性,行业发展较为缓慢。并且肉毒素产品不同于传统药物,可应用于临床治疗及医美领域,而在医美市场的销售表现则较依赖于消费者对产品及品牌的认知。因此,肉毒素赛道的生产准入和商业竞争的门槛高,导致市场较集中。目前,在全球范围内,肉毒素主要产地集中在美国、欧洲、中国、韩国等少数几个国家,市场份额被BOTOX®为主的5-6个品牌所占据。
天然肉毒素产品在医美市场销售可观。ISAPS调查数据显示,近5年来肉毒素治疗量稳居医美非外科手术处理类TOP 1,从2019年的627.1万例增长到2023年的887.8万例,五年内增长约40%,市场规模不断扩大。
根据公司年报信息,2023年,Allergen的BOTOX®产品在医美领域和临床治疗分别获得26.8亿美元、30.0亿美元的销售业绩;Ipsen的Dysport®销售额达到约7.1亿美元;Hugel的Letybo®销售额为1.2亿美元。BOTOX®凭借其先发上市的优势、产品品质的优良及品牌的高认知度,2023年以56.8亿美元的销售额远超其它肉毒素品牌,在全球独占鳌头。此外,韩国在肉毒素领域拥有的生产企业和品牌最多,主要都应用于医美领域,但多个韩国品牌的肉毒素菌株来源未得到相关机构认证,专利纠纷多次发生,甚至产品许可被吊销。总体韩国的肉毒素生产企业实力、能力、质量等良莠不齐,在全球肉毒素市场份额中比例仍然较低。
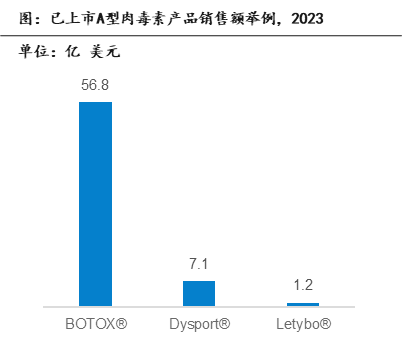
资料来源:公司年报,沙利文分析
进口产品占据中国肉毒素市场主要份额,本土研发创新引领产业格局变迁
在中国市场,根据国家药品监督管理局(NMPA)信息,截至2024年9 月13日,已有6款A型天然肉毒素产品上市,分别是Allergen公司研发的BOTOX®(保妥适®)、中国兰州生物制品研究所的衡力®、Ipsen公司研发的Dysport®(吉适®)、Hugel公司研发的Letybo®(乐提葆®),以及2024年2月上市的来自德国Merz的XEOMIN®(西马)和9月新获批的复星医药引进的Revance的达希斐®(Daxxify®)。其中,BOTOX®凭借其在医美领域的先发上市、品牌影响力、营销能力等优势,常年占据中国A型肉毒素市场份额TOP 1。
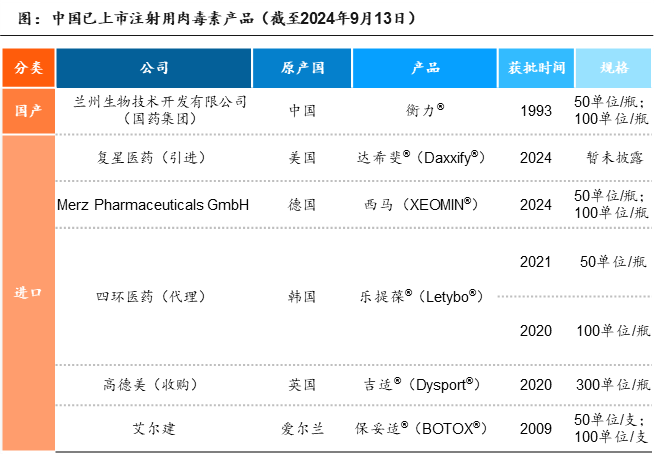
资料来源:NMPA,沙利文分析
同时,多家企业的多款A型肉毒素产品处于临床III期及上市申请阶段,包括大熊制药、爱美客(引进韩国的Huons)、Inibio、誉颜制药;艾尔建和兰州生物的已上市肉毒素产品处于拓展适应症的临床III期阶段。其中,誉颜制药的YY001管线为全球首个创新性采用重组蛋白技术并进入临床的重组A型肉毒素。重组A型肉毒素具有生物风险低、高纯度、免疫风险低、生产效率高、产能可控等优势,可破解天然A型肉毒素存在的限制成为新一代肉毒产品,有望改变现有A型肉毒素赛道格局。
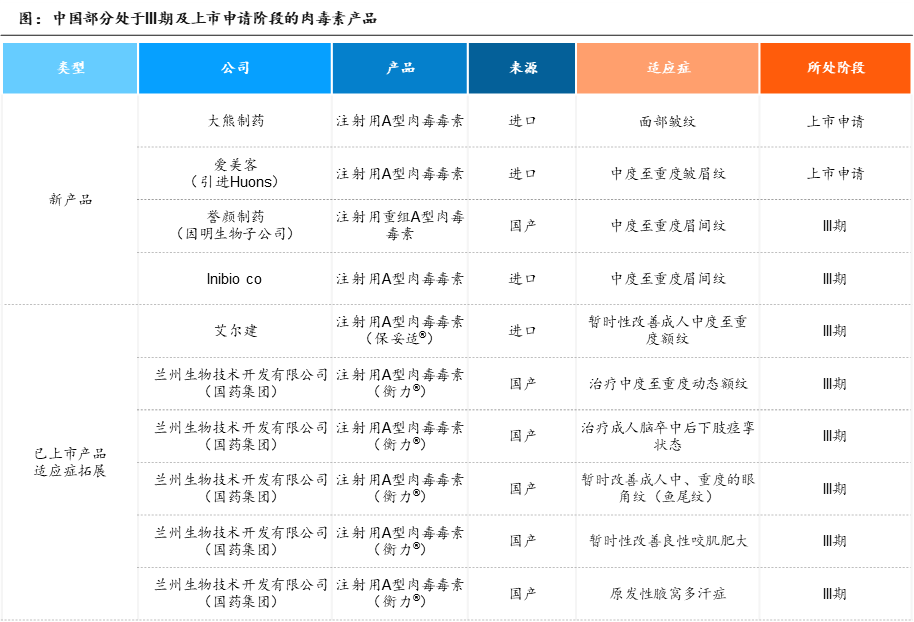
资料来源:NMPA,沙利文分析
肉毒素在创新技术迭代上仍有很大的拓展空间。传统的天然A型肉毒素由于分子结构确定,主要应用场景已基本开发。而重组A型肉毒素在重组蛋白技术上,可进一步与分子异构、融合蛋白等技术联合应用,对A型肉毒素的分子结构及作用靶点进行分析与调控,从而针对实际需求开发出起效更快、效期更长、注射更精准、使用更方便、弥散度可调控等的新型肉毒素。
肉毒素应用场景广,在医美和治疗领域均具有重要价值
A型肉毒素作用机制
A型肉毒素属于Zn2+依赖的蛋白水解酶家族,由一条100kD的重链与一条50kD的轻链组成。A型肉毒素的重链可特异性地与神经细胞包膜结合进入细胞,轻链可特异性地水解突触前膜上的SNAP-25蛋白,从而影响参与细胞内吞、胞吐功能的SNARE蛋白活性,阻碍乙酰胆碱等神经递质小泡与突触前膜融合,不能释放神经递质,引起肌肉松弛、抑制腺体分泌等化学性去神经作用。
A型肉毒素根据使用场景的差异,包括在医美机构使用,目的为改善面颈部皮肤状态、局部塑形或治疗脱发等的医美领域,以及在医院神经、康复等科室使用,通过调节神经、肌肉、腺体等功能而发挥治疗疾病作用的临床治疗领域。
A型肉毒素在医美领域深受消费者青睐,
在医美领域,A型肉毒素是一种深受消费者欢迎的微创医美手段,可应用于面颈部除皱、轮廓塑形、面部提升、改善腺体分泌、治疗脱发、预防性治疗等场景。
医疗领域潜在适应症众多,肉毒素临床价值持续展现
肉毒素具有强效的神经阻滞作用,对于肌肉过度收缩相关的异常运动或姿势、疼痛、自主神经功能亢进等疾病,肉毒素可能是有效的对症疗法。
· 治疗慢性鼻炎:A型肉毒素可改善慢性鼻炎症状,尤其是对流涕症状安全有效、疗效持久。作用机制可能包括:抑制鼻部或蝶腭神经节突触前胆碱能神经末梢释放乙酰胆碱,诱导鼻黏膜腺细胞凋亡,抑制鼻黏膜中炎症介质释放,减少鼻黏膜中的嗜酸粒细胞浸润和毛细血管扩张。
天然肉毒素监管严格,肉毒素行业准入壁垒高
天然肉毒素由肉毒杆菌发酵产生,若在生产过程中发生肉毒杆菌的泄露及传播,将造成严重的生化风险和公共卫生事件。因此,各国政府机构对天然肉毒素的研发和生产严格监管,开发和制造天然肉毒素除满足GMP要求外,还需在BSL-3或更高级别的环境中进行,并受到CDC监管。因监管严格,导致天然肉毒素产品生产门槛极高,从研发到上市的周期较长,因此产品集中在少数品牌。同时,过去由于肉毒素企业的销售和盈利可观,加之用肉毒杆菌研发过程存在安全风险,业内创新研发的动力和能力不足,监管也一直停留在传统的认知,偏于保守。
但是随着肉毒素产品技术研发热度提升,尤其是重组蛋白技术在肉毒素研发上的突破,研究领域、工业领域和监管机构对肉毒素的认知越来越深刻,对风险评估越来越客观,把控也越来越专业,加之监管机构自身的规范管理,提升效率等举措,目前肉毒素的审批时间已与其它药品类似,如分析乐提葆®(100单位/瓶)在中国药监局的上市审批时间表,从申请提报到注册获批总体历时约16个月。
肉毒杆菌是一种严格厌氧菌,对培养基要求严格,生产过程需使用BSL-3或以上的特殊建筑和设备,并对纳米加工水平要求高;鉴定纯化毒素,验证安全性及有效性较为困难;肉毒素产品贮存和运输过程普遍也需保持全程冷链。
肉毒杆菌生产肉毒素时会产生其它蛋白物质,天然肉毒素效果受到菌株、提纯工艺等因素影响,产品批次间可能出现差异。在定量检测阶段,由于制剂中蛋白含量在纳克级别,普通仪器难以精确检测,通常使用动物实验进行定量。但实验动物存在个体间偏差较大的问题,如何保证动物试验检测系统的稳定性和准确性,是肉毒素产品研发中一个关键环节,存在较高的技术壁垒。研发能力和经验强的团队,从菌株到工艺最终到动物实验的定量检测可形成系统性优势,使得批间产品质量更稳定一致,并体现为患者治疗的反应率更高,反之就可能出现产品质量起伏不定,患者治疗反应率低。
肉毒素本身为异体蛋白,注射后可能诱发机体发生超敏反应。目前上市的天然肉毒素产品,除XEOMIN®外,其它A型肉毒素产品均含有一组由若干血细胞凝集素(HA)和非毒性非血细胞凝集素(NTNH)组成的结合蛋白(NAPs),加之赋形剂的存在,注射后可能引起皮肤发生迟发型超敏反应。
A型肉毒素通常注射后3~14天起效,有效期通常为3~6个月,需多次重复注射。随着肉毒素注射次数增多,机体产生的中和抗体的滴度逐步提高,可能导致注射后继发性无应答,出现多次使用后疗效降低的情况。
重组肉毒素具有更高的纯度、安全性和更显著的反应率
A型肉毒素主要技术路线分析
根据生产技术的差异,A型肉毒素可以分为天然A型肉毒素和重组A型肉毒素两类。
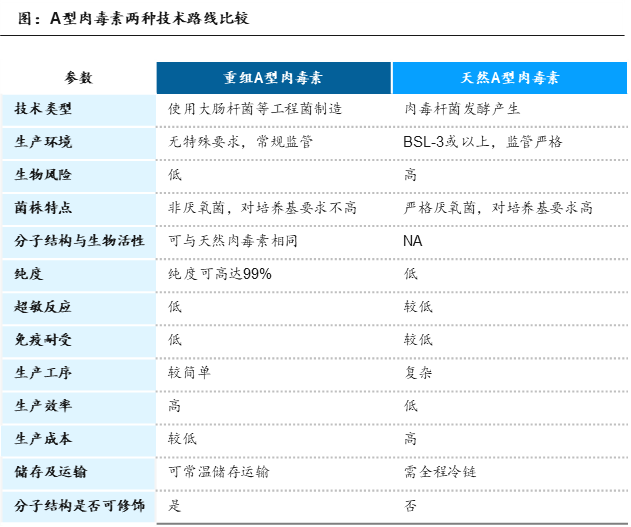
资料来源:公开信息,沙利文分析
重组肉毒素潜力看好,海内外多家企业相继布局
海外布局重组肉毒素的企业代表为Ipsen。官网数据显示,Ipsen目前仅IPN10200一条重组肉毒素管线。IPN10200为E型重组肉毒素,以患者未满足的长效治疗需求为动力,用于治疗神经系统相关的肌肉僵硬、痉挛和疼痛;通过工程化设计,提高肉毒素对受体亲和力,增强内化作用;降低肉毒素扩散到周围组织的风险,提高使用者的耐受性。IPN10200已于2021年进入临床研究,截至2024年3月,该管线有两个适应症处于临床II期试验,分别为中度至重度上面部皱纹、成人上肢痉挛。
国内布局重组肉毒素技术的企业较少。根据国家药品监督管理局药品审评中心(CDE)数据,截至2024年9月13日,仅有3款重组A型肉毒素管线进入临床阶段,分别为誉颜制药的YY001管线、君合盟生物的JHM03管线和迪新宸科的DN001管线。三家企业的研发进度不一,且产品管线的技术工艺上也有所区别:
根据公开信息,国内布局重组肉毒素赛道的企业还有若弋生物、耀海诺信等,其管线均处于临床前阶段:
誉颜制药重组肉毒素临床表现优异,研发进度全球领先
誉颜制药在研管线YY001技术特点
誉颜制药运用基因重组和蛋白表达技术开发,使用工程化大肠杆菌进行A型重组肉毒素开发。YY001的产生过程与天然肉毒素产生过程一致,先使用工程化大肠杆菌发酵产生单链蛋白,再经蛋白酶切割后变为一条重链蛋白和一条轻链蛋白,重链和轻链蛋白通过一个二硫键连接构成150kDa单一活性双链蛋白,即重组肉毒素。YY001的分子结构与天然A型肉毒素相同。鉴于天然A型肉毒素已有超过三十年的使用经验,保证了具有同样分子结构的YY001的生物功能和药理药效作用。
誉颜制药创新设计了三重过滤技术,YY001产品纯度高、比活性高、反应率显著,150kDa神经毒素比例可高达99%以上,显著高于大多数天然肉毒素(通常占制剂的13%-15%)。YY001的高纯度可降低局部给药剂量,I/II/III期临床试验显示没有特异性抗体产生,安全性更好,免疫耐受性更低。
此外,公司建设了符合GMP规范的生产设施,设计YY001冻干制剂年基础产能为200万瓶,已于2023年第一季度开始投入使用;未来YY001上市后,誉颜制药YY001产能可根据市场需求灵活调整,产能储备可满足YY001商业化后5年内的20%以上市场总需求。
YY001应用场景广泛,临床数据优异
YY001具有多个潜在适应症类型,包括眉间纹、上肢肌肉痉挛、眼睑痉挛、咬肌肥大、以及潜在的疤痕、疼痛等。在2024年9月12日针对已完成的中、重度眉间纹适应症的III期临床总结会上,誉颜制药公布的临床数据显示,YY001在大规模人群的III期临床试验中,表现出与已完成的I/II期临床结果高度的一致性,其有效性、安全性、免疫原性等都全部达到既定的临床终点,较对照药的数据表现优异。此外,誉颜制药凭借其重组蛋白的技术平台,依靠肉毒素领域内全球性的专家人才和多年积累的丰富研发经验,可展开对A型肉毒素进一步优化升级,同时开发肉毒素的更多亚型;并通过分子异构、蛋白融合等技术,有望开发出更具临床价值、适应症更广的迭代创新产品。
获批在望,YY001先发优势显著
据悉,誉颜制药在成功完成YY001的III临床试验后,即将向NMPA提交上市申报,在全球范围内就重组A型肉毒素的开发进展最快,先发优势明显。参比近几年中国获批上市的肉毒素产品注册申报时间,如吉适®注册申报时间约22个月,乐提葆®注册申报时间约16个月,达希斐®注册申报时间约17个月。考虑誉颜制药作为国内本土生产企业,相比国外生产企业在资料准备和沟通上的便捷性,预计YY001的上市申报有望更高效率实现,成为全球首款上市的重组A型肉毒素产品,从而在商业化销售上延续先发优势,将更有利于YY001上市后的市场表现。
携手华东医药,加快推进YY001市场渠道布局
2023年11月,华东医药与誉颜制药签署了产品独家经销协议,获得YY001在中国大陆、香港、澳门地区医美适应症领域的独家经销协议。
华东医药业务覆盖医药全产业链,其中医美业务板块聚焦全球医美高端市场,包括Sinclair、欣可丽美学等多家子公司,在全球多国设有研发中心及生产基地,建立了近300人的专业化市场推广团队,已搭建起全球化医美营销网络,产品销售已覆盖全球80多个国家和地区。其中,欣可丽美学为华东医药在国内的市场运营平台,在其推广下,再生型填充剂Ellansé®伊妍仕®自上市不到3年时间,已实现合作医院数量超600家,培训认证医生数超1,100人。YY001借助华东医药的医美市场营销平台,有望在上市后快速渗透全国医美机构,改写国内肉毒素竞争格局,并凭借其出色疗效成为全球化肉毒素品牌。
结语
在重组肉毒素赛道,中国企业研发进度已走在世界前沿。未来,预计随着YY001作为全球首款重组肉毒素获批上市,中国将成为重组肉毒素制造和生产大国,引领全球肉毒素行业步入新时代。







