本文转载自“医药魔方”。
靶向治疗可选择性地杀伤癌细胞,而对健康组织不产生影响。选择好的药物靶点是成功开发这类疗法的重要一环。近几年,CRISPR已成为用于肿瘤药物靶点发现的独特工具,可用来突变、抑制或激活任何目标人类基因。

图片来源:Nature
4月10日,来自英国Wellcome Sanger研究所等机构的科学家们在Nature杂志上报道了一项重大成果[1]:利用这一“魔剪”,研究人员破坏了30种癌症类型300多种癌症模型的每一个基因,最终发现了数以千计对癌症生存至关重要的基因。之后,通过一个自主研发的新系统,他们对600多个最有希望的药物靶点进行了优先级排名。
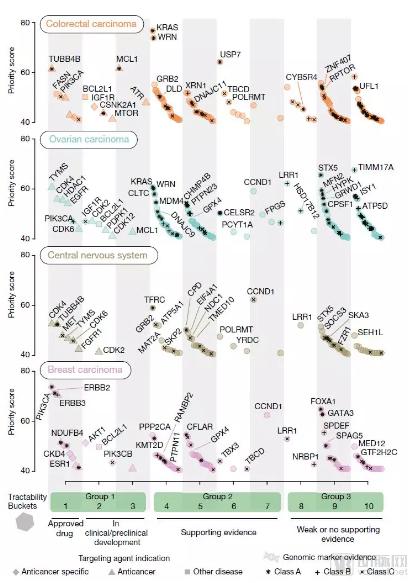
4种特定癌症类型的优先靶点(图片来源:Nature)
研究中,Mathew Garnett博士等开展了迄今为止规模最大的癌症基因CRISPR筛查之一,涉及的癌症类型包括肺癌、结肠癌、乳腺癌、卵巢癌和胰腺癌等,共计324种人类癌细胞系,分析了近2万个基因。
628个靶点一览
他们根据可操作性(tractability)将628个最有前途的靶点分成了3组。
1组由已批准抗癌药的靶点或一些处于临床或临床前开发阶段的候选药物的靶点组成,共计40个(下图),如乳腺癌中的ERBB2、ERBB3、CDK4、AKT1、ESR1、TYMS 和PIK3CB,以及结直肠癌中的PIK3CA、IGF1R、MTOR 和 ATR(不同癌种1组靶点的优先级得分见文末)。
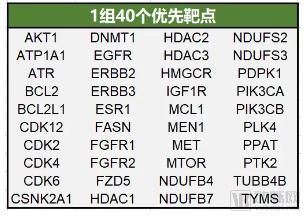
数据来源:Nature;制图:医药魔方
2组包含277个优先靶点(下图),目前没有针对这些靶点的药物在临床开发阶段,但有证据支持这些靶点的可操作性。
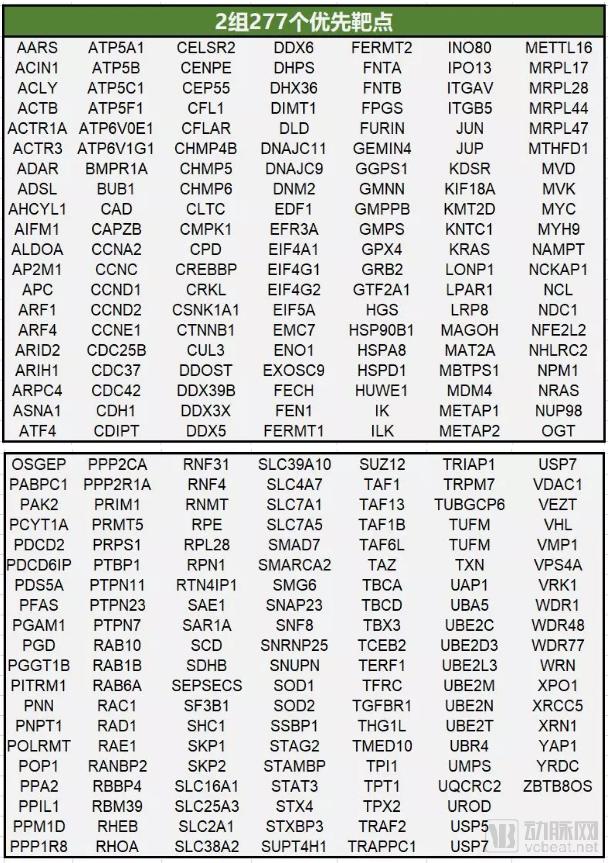
数据来源:Nature;制图:医药魔方
3组包含311个优先靶点(下图),目前没有信息或缺乏信息支持它们的可操作性。
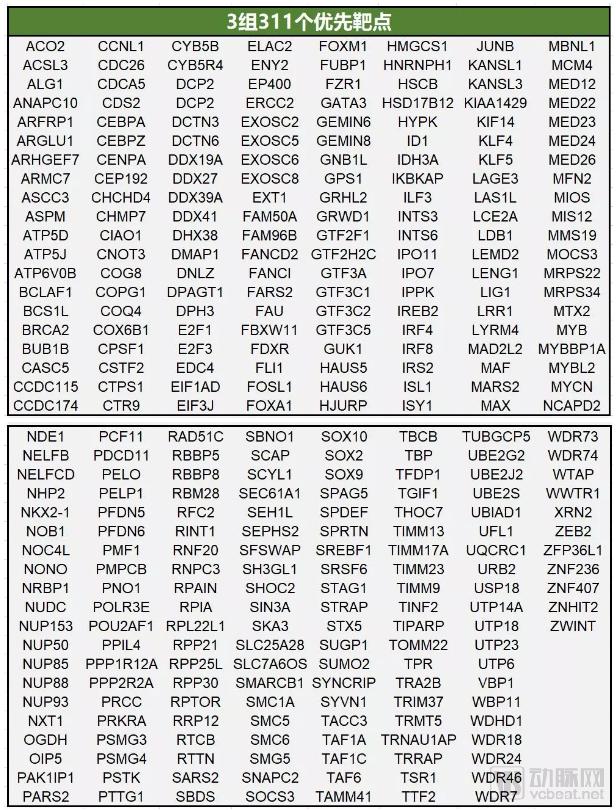
数据来源:Nature;制图:医药魔方
关键靶点WRN
这些靶点中,WRN(Wernersyndrome RecQ helicase,一种解旋酶,通过解开基因组的双螺旋结构来帮助细胞复制或读取DNA)在多种不同癌症类型中的可操作性得分均较高。
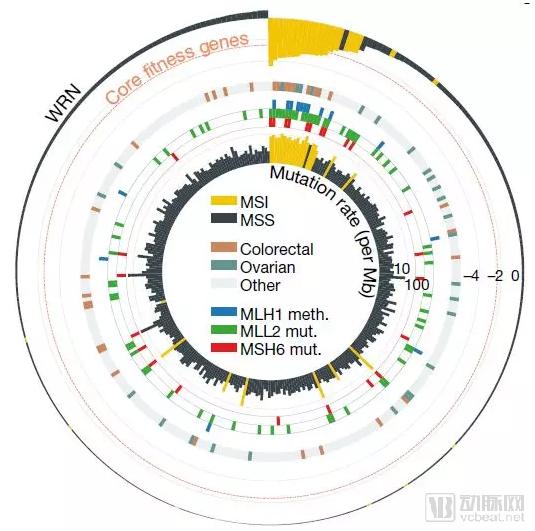
WRN是MSI癌细胞的靶点(图片来源:Nature)
研究人员发现,DNA错配修复机制有缺陷的癌细胞,即微卫星不稳定(microsatellite instability,MSI)癌症,需要WRN才能存活。MSI与肿瘤高突变负荷有关,发生在20多种不同类型的癌症中,在结肠癌(15%)、卵巢癌(12%)、子宫内膜癌(20%-30%)和胃癌(22%)中较为常见。
Garnett博士等认为,WRN是一个非常有希望的药物靶点。该结论与同日发表在Nature上的另一篇论文[2]获得的发现一致。

图片来源:Nature
这项由Broad研究所的科学家领导的研究利用CRISPR和RNAi技术调查了近千个癌细胞系,结果发现,73%的MSI癌细胞系依赖WRN;相比之下,MRN缺失对非MSI癌细胞系的影响相对较小。研究还发现,抑制WRN的表达可显著延缓小鼠MSI癌症的生长。

图片来源:Nature
失去错配修复功能的癌细胞为何会依赖WRN尚不清楚。但研究显示,仅失去配修复机制似乎也不足以导致癌细胞依赖WRN。当研究小组在MSI癌细胞中重新激活这一机制时,虽然对WRN的依赖程度降低了,但这类细胞并没有完全丧失对WRN的依赖。
科学家们表示,健康、基因稳定的细胞很能承受这种酶的缺失,表明阻断WRN的药物应该主要影响依赖WRN的癌细胞,但对正常细胞相对无害。此外,虽然遗传性WRN缺失会导致一种叫做Werner综合征的疾病,但症状的出现需要几十年的时间。这也表明,通过干扰WRN来抗癌是可行的。另一方面,MSI(临床上已经有可用的测试能够评估这一特征)很显然可以作为靶向WRN疗法的生物标志物。由于目前还没有直接靶向WRN的药物,研究者们希望这些证据能推动VRN抑制剂的研发,用于治疗含MSI的肿瘤。
总结来说,这两项研究,尤其是Mathew Garnett博士等人的研究使科学家们离绘制“癌症依赖地图”(Cancer Dependency Map)又近了一步,将加速癌症靶向疗法的发现,最终帮助实现癌症的靶向精准治疗。
【附】不同癌种1组靶点的优先级得分

数据来源:Nature