2015年1月20日,美国总统奥巴马(Barack Obama)在国情咨文中首次提出精准医学(precisionmedicine, PM)计划。奥巴马提到,美国已成功消除脊髓灰质炎并顺利完成人类基因组计划,希望借助精准医学计划,让美国进一步引领医学新时代。
精准医学与癌症精准医学
精准医学是一种在充分考虑个体间差异的前提下针对个人或特定人群疾病开展的诊断、治疗、预防及护理等的新模式,通俗而言,就是在合适的时间为合适的患者提供合适的治疗。精准医学计划的提出,是基于基因组测序技术突飞猛进,此外如转录组、蛋白质组、代谢组等也产生海量数据,激发了大数据分析工具的开发,形成以云计算为主的平台。
精准医学是立足于基因组大数据之上的一种医学模式,首要目标是实现疾病的重新定义。传统的疾病分类主要基于临床症状和体征检查等;而精准医学的疾病分类则在此技术之上还要全面考量疾病发生的分子标志物、基因多态性、居住环境、生活方式等相关信息,最终形成一个基于分子生物学的疾病分类新模式。
癌症仍是人类最主要的致死原因,并随着全世界老龄化社会的到来而发病率剧增。世界各国都对癌症研究投入巨大人力和物力,而美国精准医学计划所设定的近期目标就是在癌症诊治方面实现突破,侧重于进一步从癌症基因组中筛选和鉴定驱动基因的突变(driver mutation),在此基础上开发更有效的癌症诊疗方法。
癌症精准医学计划希望进一步借助基因组测序和信息分析,来解释癌症药物抗性的原因,阐明癌症基因组的异质性特征,解析癌症复发和转移的机制,建立癌症联合用药新的应用指南等;最终形成对癌症精确诊断、分子分型、治疗应答预测的标志物等一整套精准医学指标。
癌症精准医学回顾——从“魔蛋”到靶向
癌症治疗从广义上可分为物理疗法(包括手术、辐射、光、电、磁、热和冷等)和化学疗法(包括小分子化合物、大分子蛋白质抗体和免疫细胞治疗等)。随着技术的进展,癌症物理疗法在精准方面也取得了巨大的进步(如氩氦刀等),但本文重点介绍癌症化学疗法的精准医学。
精准医学概念早已有之,也是人们的愿望之一。早在19世纪末20世纪初,德国免疫学家艾尔利希(Paul Ehrlich,1908年诺贝尔生理学或医学奖获得者)就提出“魔弹”(magic bullet)的概念。魔弹的基本理念在于两方面:首先能够找到“靶”,也就是致病原因(微生物或分子);其次能够设计出针对这个“靶”的神奇化合物(“魔蛋”),该化合物选择性地(只针对“靶”)发挥药理作用,而对非靶点无杀伤或无明显副作用。“魔弹”理论开启了药物治疗的新时代,同时确立了最朴素的精准医学概念,艾尔利希因此被誉为“化疗之父”。
癌症化疗的突破
从理念的提出到实际应用,其间有许多难题尚需解决。以癌症为例,首先要解决的是治疗靶点。1940年代,科学家提出抗代谢理论来解释磺胺类药物的抗菌作用,而科学家在此基础上推论,通过抑制癌细胞的代谢特别是核苷酸代谢,亦可实现抑制癌细胞的目标。1950年代,美国科学家埃利昂(Gertrude Elion)和希钦斯(George Hitchings)筛选到嘌呤类似物6-巯基嘌呤(6-mercaptopurine,6-MP)具有高效抗癌活性,从
而掀起了癌症化疗药物开发和应用的高潮,极大地推动了癌症治疗领域的快速发展,两位科学家也因此分享了1988年的诺贝尔生理学或医学奖。
然而,传统化疗还是较为初级的“靶向”治疗,药物靶点基本锁定在细胞分裂和细胞代谢,大部分为细胞毒化合物,因此在杀伤癌细胞的同时,对正常分裂细胞也具有杀伤作用,意味着“区分度”较低,临床毒副作用较大,但化疗药物如铂类化合物、紫杉醇等的广谱效应,使其仍为当前大部分癌症治疗之首选。寻找更为特异的癌症治疗“靶点”,成为科学家重要的研究方向之一。
蛋白激酶抑制剂的应用
20世纪60年代,科学家发现慢性粒细胞性白血病(chronicmyeloid leukemia, CML)患者细胞中存在“费城染色体”;1970年代,科学家证明“费城染色体”的形成源于染色体易位(9号和22号染色体之间),导致9号染色体的ABL基因和22号染色体的BCR基因融合形成新基因BCR-ABL,这个新基因表达一种持续激活的酪氨酸激酶ABL,引发正常细胞癌变而发生失控增殖,从而意味着抑制ABL酶活性将对CML的治疗有重要益处。
1980年代中期,美国肿瘤学家德鲁克(Brian Druker)和生物化学家莱登(Nicholas Lydon)决定筛选ABL的特异性抑制剂。经过十余年努力,1996年终于鉴定出伊马替尼(Imatinib,商品名格列卫)可选择性地杀死具有BCR-ABL基因融合的癌细胞,而对其他类型癌细胞以及正常细胞均无杀伤效应,是一个重要的“魔蛋”。随后动物实验和1998年开始的临床试验均证实,伊马替尼对CML有极好的疗效,且副作用远小于传统化疗。2001年5月,美国食品和药品管理局(FDA)正式批准这种新药用于临床。
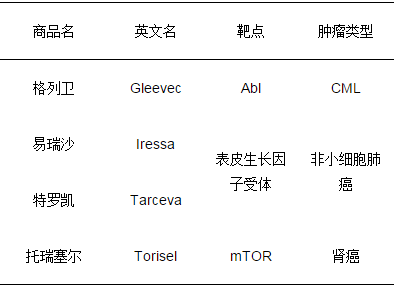
格列卫代表了一种全新的癌症治疗策略,与此同时,多种小分子激酶抑制剂被开发成功,部分经FDA批准用于特定肿瘤的治疗,如易瑞沙和特罗凯治疗表皮生长因子受体突变型非小细胞肺癌,托瑞塞尔治疗哺乳动物雷帕霉素靶蛋白(mammaliantarget of rapamycinm, mTOR)激活型肾癌等。
肿瘤靶向治疗常用的小分子抑制剂
单克隆抗体治疗癌症的成功
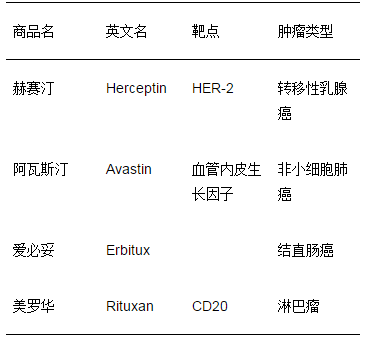
抗体是具有靶向效应的蛋白质大分子。科学家很早就期望能将特异性作用的抗原-抗体反应用于癌症的靶向治疗,但是直到1975年,科学家科赫勒(Georges Jean Franz Köhler)和米尔斯坦(César Milstein)发明了杂交瘤制备单克隆抗体的技术,才为此扫清了技术障碍。1990年代,以赫赛汀(Herceptin)为代表的多种癌症治疗单克隆抗体开发成功并广泛应用于临床。
肿瘤靶向治疗常用的单克隆抗体
1984年,基因泰克公司(Genentech)乌尔里希(AxelUllrich)等人首先完成了人表皮生长因子受体2(humanepidermal growth factor receptor 2, HER-2)的基因克隆;1987年,加州大学洛杉矶医学院的斯拉门(Dennis Slamon)及其同事首次发现了约1/4的侵袭性乳腺癌患者存在HER-2基因的过表达,并且这种过表达与乳腺癌治疗后的复发和不良预后成正相关,由此预示了HER-2可作为一种乳腺癌治疗的靶点。
1992年,基因泰克公司制备成功人源化HER-2单克隆抗体(Trastuzumab)并开始临床试验。1998年,FDA利用快通道方式批准其用于转移性乳腺癌治疗,商品名赫赛汀,并进一步批准赫赛汀与紫杉醇联合作为乳腺癌一线用药。
赫赛汀以及一年前批准的治疗非霍奇金淋巴瘤的美罗华共同开创癌症单克隆治疗的新路,引起癌症治疗领域的一次重大革新,大大地延长了患者的生存期并提高了生存质量。目前已有七十多种单抗(单克隆抗体)用于特定类型癌症的治疗,推动了癌症精准医学快速发展。
除开发出针对癌症突变分子的单抗药物外,近几年比较活跃的还有针对免疫检验点分子包括细胞毒性T细胞相关抗原4(cytotoxic T lymphocyte -associated antigen-4, CTLA-4)、程序性死亡受体1(programmed death 1,PD-1)和程序性死亡配体1(programmed death ligand 1,PD-L1)等的单克隆抗体,在多种癌症的治疗中亦显示出理想效果。
癌症精准医学的方向——测序指导模式
随着癌症基因组计划的深入发展,鉴定出大量癌症驱动的基因突变(driver mutation),为癌症精准医学之全面实施提供了保障。
分子标志物的筛选和鉴定
癌症精准医学首要解决的问题是癌症分子的分型,以区别于传统的分类方法,如HER-2阳性乳腺癌(采用赫赛汀治疗)等。癌症基因组图谱(Cancer Genome Atlas)计划已筛选和鉴定出多种与癌症发生、发展、侵袭和转移等过程有关的关键基因,接下来会利用大样本验证这些基因在癌症诊断、治疗或预后判断中的特异性,从而建立起一个全新的癌症精准医学分类模式。
癌症精准预防
在对癌症的有效治疗手段相对有限这个前提下,目前开展癌症预防的意义更为重大,而早期预警是重要的保证,乳腺癌BRCA1(breast cancer 1)和BRCA2基因的筛查为典范之一。BRCA1和BRCA2是两个抑癌基因,其编码蛋白质主要修复损伤DNA以保证基因组的完整性,它们的突变可导致细胞突变增加而癌变。5%~10%乳腺癌和约15%卵巢癌存在BRCA1和BRCA2突变,这种突变可使癌症发病时间明显提前,因此可对具有乳腺癌家族史的人群定期开展基因检测,有效评估癌症发展情况,以尽可能保证在癌症早期实现疾病干预。利用基因组测序技术和随后的大样本验证,鉴定出有效的癌症发病关键基因,就能在早期实现对多种高危人群包括家族史、不良生活史、病毒感染等进行筛查的目的,从而对不同患者“量身定做”相关的预防措施。这种做法有两方面的重要意义,一是减轻患者痛苦和提升治疗效果;二是为更多肿瘤干预手段的介入提供最佳时间节点,以及开发更廉价的预防药物等。
精准靶向治疗
治疗是癌症精准医学的重中之重。精准治疗主要涉及两方面任务,一方面是使传统治疗方法实现精准化,另一方面是开发新的治疗手段,如“测序指导的免疫治疗”。
手术后放化疗仍是晚期癌症治疗之主要手段,但由于晚期癌症患者的机体耐受性差和治疗本身的副作用巨大,亟须采取新的策略以完善治疗措施,测序技术的发展为此提供了突破的可能性。借助基因组测序数据和大规模队列分析,可以鉴定出放化疗等传统方法的敏感基因和抵抗基因,从而保证针对不同的患者采用不同治疗策略,一方面提升治疗效果,另一方面降低治疗副作用。
测序指导的癌症免疫治疗是精准医学的一个重要方向。其基本原理在于癌症细胞中的基因错义突变产生的突变蛋白质,可作为一种肿瘤新抗原被机体免疫系统识别,而启动T细胞免疫实现有效杀伤,这是正常情况下机体抑制癌症发生的自我保护机制。如果由于种种原因,这种免疫机制弱化或者消失,就造成癌细胞无法被及时清除,最终引发癌症,所以利用癌症新抗原增强机体T细胞免疫的策略,在癌症治疗中具有重要意义。
肿瘤特异性突变可通过基因组测序和质谱等方法筛选和鉴定,其在免疫治疗方面有两种策略。一种是利用自体T细胞的体外特异性,在扩增过程中补充肿瘤特异性突变肽而增加其特异性,随后回输到患者体内达到癌细胞杀伤的目的,这种方法已在胃肠道肿瘤的治疗中得到应用。另一种策略是疫苗化,将癌症新抗原和免疫佐剂共同注射入体内,直接激发体内T细胞的特异性杀伤作用。树突细胞拥有天然佐剂功能,可用于抗原递呈,因此利用肿瘤新抗原处理树突细胞后回输给患者,亦可增强杀伤癌细胞的特异性免疫能力而达到缩小肿瘤之目的,该策略在晚期黑色素瘤的治疗中显示出巨大潜力。
癌症精准护理
癌症治疗的最高目标(也是最终目标)是治愈,中期目标是转变为慢性疾病,最低目标是在实现疗效最大化的前提下尽可能降低费用。就癌症精准医学而言,中期目标是一个最现实的努力方向,“带瘤生存”也可被大多数患者接受。借助精准医学计划能针对每名癌症患者的自身特征,制定出有效的护理方案,最大限度地延长生存时间和提升生存质量。
面临的机遇和挑战
精准医学将带来各医疗领域的突破,带动整个健康产业的革命性发展,为全面促进与提升医学事业打开新局面,谱写新篇章。
癌症是个世界性的难题,仅美国每年与癌症相关的费用就高达上千亿美元。从1970年代的“向癌症开战”计划,到1990年代的人类基因组计划,再到20世纪初的癌症基因组计划,无不围绕癌症展开。今天的精准医学计划可看做人类基因组计划之延伸版,亦可看做“向癌症开战”计划之升级版(2.0版),它必将促使各国加大对癌症研究的投入。包括美国、欧盟和我国等都在积极探索下一步实施细则,对计划的完成起推动作用。
机遇又与更多挑战并存。首先,精准医学计划的提出,并非建立在科学层面,更多地是基于经济和政治的考虑。目前,科研活动过于依赖政府力量,而忽视了科学共同体的内部特征和科学自身的发展规律。寄希望于通过几个计划来解决科学问题,更多地体现了人们美好的一厢情愿而已。
精准“靶点”寻找
今天,基因组测序已成为一种常规性手段,但对产生的海量数据做信息分析仍是一大难题。如何从癌症基因组信息中鉴定出“靶点”,尚缺乏固定模式,大多基于经验方法,这就极大地限制了精准医学的全面开展。
神奇“魔蛋”制备
筛选到理想靶点还只是完成了第一步,更艰巨的任务是找到干预或治疗的理想手段。许多重要的癌症相关基因如p53、Ras等虽已研究多年,目前仍缺乏应用于临床的有效药物。免疫治疗也仅提供了一种选择,寻找更多的治疗策略还面临重大挑战。
癌症异质性
异质性(即癌症组织内部存在多个突变类型)是癌症的基本特征之一,也是开展精准医学的最大难题。即使治疗靶点和治疗都非常有效,也只对部分癌细胞有效;尽管能做到精准杀伤,但是那些躲过“灭顶之灾”的非靶向癌细胞,可能会更疯狂地增殖和转移,最终造成治疗失败。
医疗花费
癌症是所有疾病中花费增幅最快的疾病,每年以14%递增,而精准医学的开展可能进一步加快这种趋势。以美国为例,每年60万人死于癌症,130万人诊断出癌症。如果每个死亡个体要延长一年的生存期,就需要花费10万美元的精准抗癌药物,造成美国医疗每年600亿美元的负担;而如果延长5年生存期,则花费进一步提升到3000亿美元。
最大挑战还在于:精准医学的概念和人体的复杂性有内在不可调和的矛盾。医学的基础和临床研究大都基于统计学原理,极少应用确定性较高的数学模型,这将意味着医学“永远”不可能精准。
总之,探索癌症治疗的路还很漫长,精准医学计划可能对此有一定帮助,但真正的突破还应寄希望于癌症新机制的发现或治疗新思路的提出。精准医学在癌症治疗方面有着美好的前景,但同时面临着更多棘手的难题,用哲学语言表述就是:前途是光明的,道路是曲折的。
总结三句话:
(1)钱能解决的问题就不是问题,一切皆然,科学也不例外;
(2)人类一思考,上帝就发笑,计划一出台,大家就开心
(3)重大科学发现都无法预测,至少癌症治疗领域尚未出现真正意义突破,何时出现不知。