在一项新的研究中,来自美国耶鲁大学的研究人员在活体小鼠体内构建出功能性“人源化(humanized)”肝脏,这将有助于科学家们找到调节胆固醇水平的人体特异性机制,并有可能治疗困扰美国数千万人的慢性肝病。相关研究结果于2023年8月9日在线发表在Cell期刊上,论文标题为“Humanized mouse liver reveals endothelial control of essential hepatic metabolic functions”。

酒精性肝病、非酒精性肝病、肝癌、病毒性肝炎和肝纤维化等慢性肝病影响着全球超过15亿人。在美国,估计有30%到40%的人仅被诊断患有非酒精性肝病。然而,肝病一直难以在动物模型中进行研究。这是因为诸如小鼠之类的动物的肝脏在功能上与人类不同。
论文通讯作者、耶鲁大学医学院斯特林免疫生物学教授Richard Flavell说,“在肝脏内部,多种人类细胞类型用自己的语言交谈。小鼠和人类细胞用不同的语言交谈,但我们成功地让人类肝细胞在活体小鼠体内用自己的语言交谈。”
图片来自Cell, 2023, doi:10.1016/j.cell.2023.07.017。
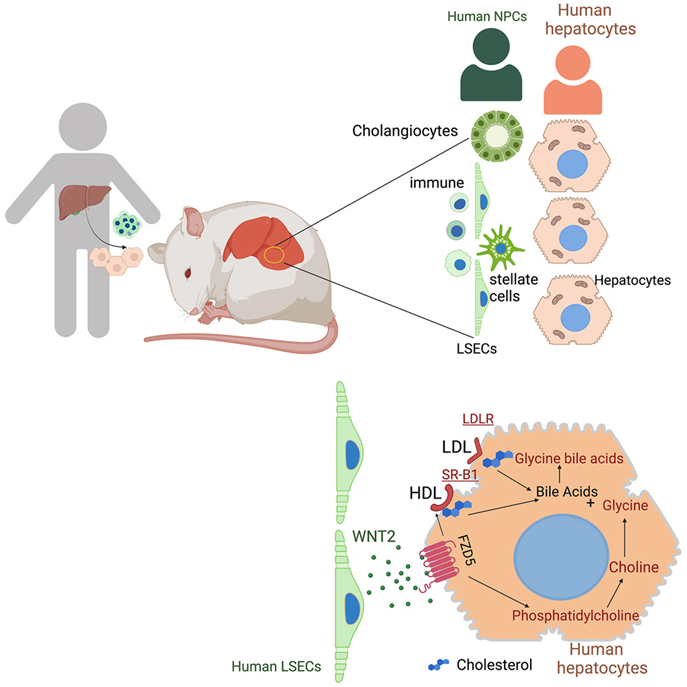
在这项新的研究中,Flavell实验室副研究员Eleanna Kaffe领导的一个研究团队,利用来自人类肝脏的非实质细胞(non-parenchymal cell, NPC)---包括人体免疫细胞、内皮细胞和星形细胞---和称为肝实质细胞(hepatocyte)的成熟细胞,在小鼠模型中构建出完整的人类肝脏。这些作者说,这种人源化肝脏发育成与健康人肝脏相似的大小调整形状,并具有相似的细胞功能。他们报告说,这种人源化肝脏中的细胞功能也可以通过操作来模拟人类肝纤维化和非酒精性肝病。
这些作者还发现,肝脏的基本代谢受肝脏内皮细胞活动的控制,而肝脏内皮细胞排列在为肝脏供血的血管上。他们说,这些肝脏内皮细胞会分泌一种叫做Wnt的信号分子,它能调节胆固醇向肝细胞的运输,以合成胆汁酸。胆固醇向肝细胞的运输是降低人体血液中过量胆固醇水平的一个重要机制。
据这些作者的说法,这种人源化肝脏模型可立即用于制药公司,以评估治疗慢性肝病的实验药物的安全性。他们说,“然而,我们的长期目标是找到预测、预防和治疗所有肝脏疾病的方法,因为肝脏疾病会给患者带来巨大的伤害。”
文章来源“生物谷”






