CD3δ重症联合免疫缺陷(CD3δ-SCID)是一种罕见且致命的遗传性免疫缺陷疾病,由CD3δ基因的C→T单碱基突变所致,这一突变导致终止密码子提前,CD3δ蛋白的翻译被提前终止,而CD3δ蛋白是血液干细胞正常发育为T细胞所必需的。
患有CD3δ-SCID的婴儿缺乏T细胞,因此在出生后无法抵抗感染,如果不治疗,他们通常在出生后两年内死亡。目前,骨髓移植是治疗这种疾病的唯一可行的方法,但众所周知,骨髓配型非常困难,而且骨髓移植这一过程对于CD3δ-SCID婴儿来说也充满风险。
2023年3月20日,加州大学洛杉矶分校 Donald Kohn 实验室在 Cell 期刊发表了题为:Human T cell generation is restored in CD3δ severe combined immunodeficiency through adenine base editing 的研究论文。
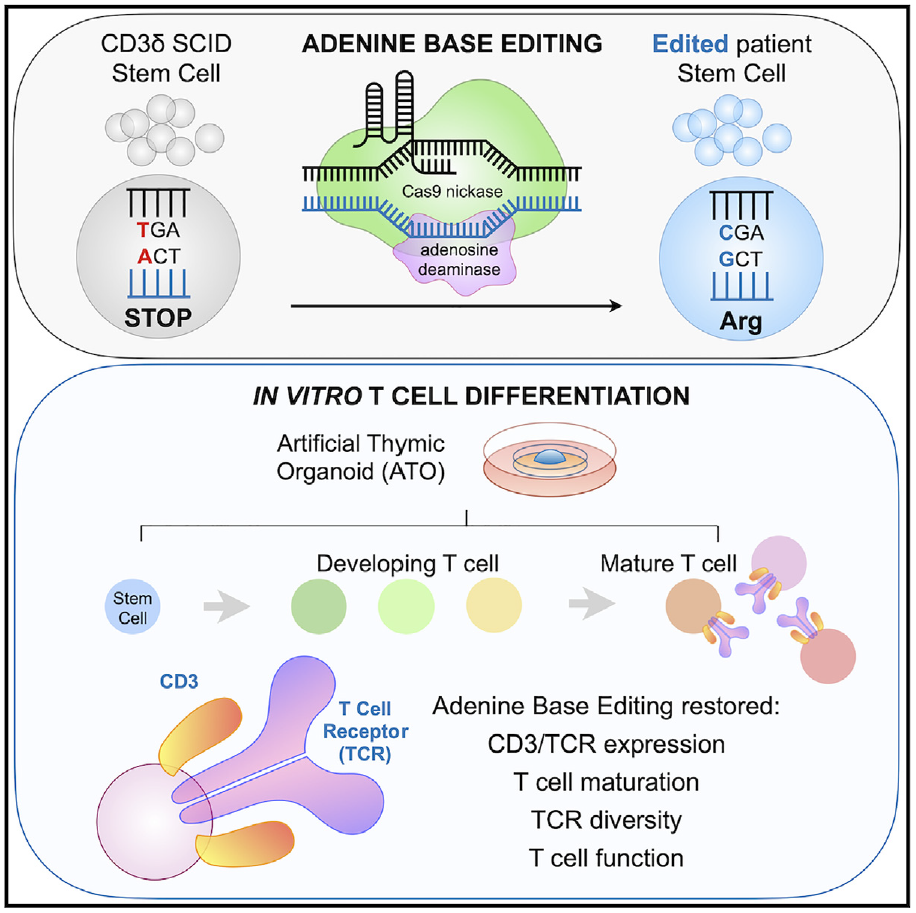
这项研究表明,碱基编辑(Base Editing)技术可一次性治疗罕见而致命的遗传疾病——CD3δ重症联合免疫缺陷(CD3δ-SCID)。他们使用腺嘌呤碱基编辑器(ABE)纠正了患者造血干细胞和祖细胞(HSPC)中CD3δ基因的致病单碱基突变,从而恢复了血液干细胞产生T细胞的能力,为CD3δ-SCID患者带来了一次性治疗新选择。

Donald Kohn 教授实验室此前曾成功开发过几款免疫缺陷疾病的基因疗法,包括其他类型的重症联合免疫缺陷(SCID),这一次,他们把目光放在了CD3δ-SCID上,希望为这种疾病的患者找到更好的治疗选择。
而这一次,他们选择了实验室之前从未尝试过的新技术——碱基编辑。碱基编辑是由刘如谦(David Liu)团队开发的新一代基因编辑技术,能够在不引起DNA双链断裂的情况下修复单碱基突变,因而被认为比CRSIPR-Cas9技术更安全、更精准。
研究团队与碱基编辑技术的开创者刘如谦教授合作,选择了腺嘌呤碱基编辑器(ABE),ABE能够催化A·T→G·C的转换,从而修复CD3δ-SCID患者的致病突变,研究团队对正在接受骨髓移植的CD3δ-SCID患者捐献的造血干细胞和祖细胞(HSPC)进行研究。
研究团队将编码实验室进化版本的ABE的mRNA和gRNA递送到CD3δ-SCID患者捐献的造血干细胞和祖细胞(HSPC)中,实验结果显示,平均修复了71%的致病基因突变。
接下来,研究团队与加州大学洛杉矶分校的 Gloria Yiu 博士合作,测试经过ABE修复的HSPC细胞是否能产生T细胞。Gloria Yiu 博士使用了 Gay Crooks 实验室开发的人工胸腺类器官(Artificial Thymic Organoids,ATO)进行研究,这种人工胸腺类器官能够模拟人类胸腺环境,胸腺是血液干细胞分化为T细胞的场所。
实验结果显示,ABE修复的HSPC细胞被引入人工胸腺类器官后,产生了功能完全且成熟的T细胞。这表明了对CD3δ-SCID患者的干细胞进行碱基编辑可以修复他们的致病基因突变。
最后,研究团队将这些ABE修复后的HSPC细胞移植到免疫缺陷小鼠体内以研究它们的寿命,结果显示,这些碱基编辑后的细胞在移植后四个月时仍然存在,这表明经过碱基编辑的HSPC细胞可以长期存在,并产生了正常免疫系统功能所需的T细胞。
这项研究充分展现了团队科学之美,将临床需求与科学专业知识相结合,为患者带来了新的、更具潜力的治疗选择。据悉,研究团队正在进一步探索将这种新方法应用于CD3δ-SCID婴儿的临床试验。
论文链接: https://doi.org/10.1016/j.cell.2023.02.02







