衰老是影响新冠疫苗效果的一个关键风险因素。虽然疫苗效力的下降可以广泛地归因于免疫衰老的影响,但导致老年人疫苗应答不足的分子机制仍然知之甚少。中国于 2021 年 7 月开始对 60 岁以上的老年人进行全面疫苗接种。据报道,灭活病毒疫苗在 18-59 岁的人群中具有足够的免疫防护,同时观察到,在老年人中可以诱导中和抗体的产生。
然而,尚未有系统地评估老年人对新冠灭活病毒疫苗的综合免疫反应,特别是 T 细胞反应。因此,迫切需要解析老年人对疫苗免疫反应,尤其是特异性 T 细胞和中和抗体免疫应答不足的机制。
2023 年 3 月 14 日,由暨南大学陈国兵教授、罗钧洪教授,梁晓峰教授,王鹏程副教授领衔、多单位科研团队合作于Nature Aging 期刊发表了题为:Insufficient epitope-specific T cell clones are responsible for impaired cellular immunity to inactivated SARS-CoV-2 vaccine in older adults 的研究论文。
该工作以年轻和老年灭活疫苗接种队列的外周免疫细胞为研究对象,通过新冠病毒抗原特异性 TCR 免疫组学和人工智能机器学习分析,阐明了老年人接种新冠病毒灭活疫苗后免疫功能变化的分子机制,即老年人体内抗原特异性候选 T 细胞克隆的不足导致了老年人抗新冠病毒免疫的慢速应答。

该研究招募了 121 名年轻志愿者(18-30 岁)和 48 名老年志愿者(60-85 岁),分别在 4 个时间点收集外周静脉血:接种前、第 1 次接种后 14 天、第 2 次接种后 7 天和 50 天,检测中和抗体和细胞免疫水平,以评估新冠病毒灭活疫苗接种后的免疫保护作用。同时,建立了人工抗原递呈系统,全面筛选了新冠病毒野生型和包括 omicron 在内的 13 种变异株中的所有 CD8 T 细胞优势表位,快速制备了基于抗原表位肽的荧光标记 pMHC 四聚体用于标记抗原表位特异性 CD8 T 细胞。分选了疫苗接种前后外周血中 CD4 T、CD8 T 和 B 细胞分别进行 RNA-seq,以研究不同年龄人群对疫苗接种后的免疫应答差异的分子机制。同时分选抗原特异性 CD8 T 细胞,进行单细胞 RNA-seq 和配对 TCR-seq 检测,建立了抗原表位特异性 TCR 组库。最后,通过高通量测序研究疫苗接种前后的免疫细胞受体(BCR 和 TCR)组库,特别是新冠病毒抗原特异性 TCR 组库的大小和多样性,研究年轻和年老在疫苗接种前后免疫应答差异及老年人免疫应答不足的精准机制。
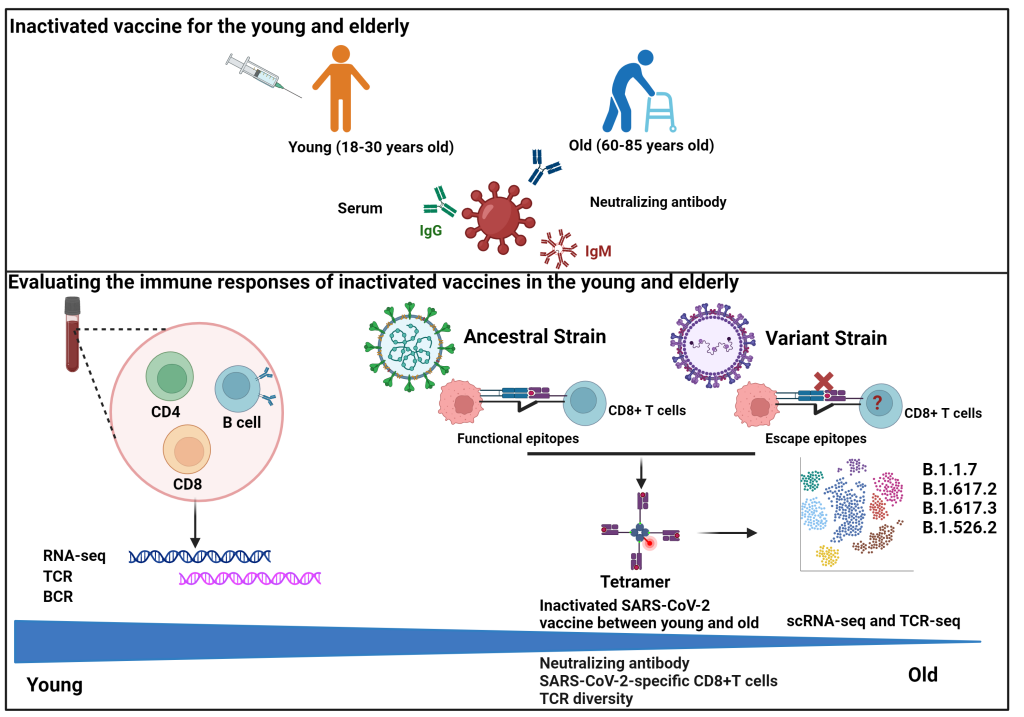
研究结果表明,121 个新冠特异性 CD8 T 细胞抗原表位,其中 13 个 T 细胞抗原表位在变异株中突变后导致 T 细胞免疫反应下降。抗体方面,老年人在 50 天后可以达到年轻人抗体水平的 67%,而细胞免疫只达到 33%,且老年人疫苗接种后的细胞免疫对新冠病毒突变株的保护效率更低。
为了全面了解疫苗接种后年轻和年老受试者之间抗体产生和细胞免疫反应差异背后的潜在机制,转录组数据分析显示,抗原递呈信号减弱可能是老年人对疫苗免疫应答不佳的主要原因。免疫细胞受体组库研究发现 BCR 和 TCR 数目大小和多样性的减少导致了老年受试者疫苗接种后应答不佳。
最后研究者使用人工智能机器学习算法来评估接种前后年轻和年老供体的 CD8 TCR 库的 SARS-CoV-2 表位特异性,发现新冠病毒特异性 CD8 T 细胞的候选克隆数目在老年受试者中明显低于年轻人,且在疫苗接种后的活化扩增能力明显低于年轻人。
总体而言,该研究是目前为止针对老年人对新冠灭活疫苗免疫应答表现及其机制研究的最全面和深入的系统研究,并且提供了直接的直观证据显示,老年人体内表位特异性 T 细胞候选克隆数目低下是老年人疫苗接种后表现不佳的主要原因。
该研究受科技部国家重点研发计划「主动健康与老龄化科技应对」重点专项,国家自然科学基金委,重大研究计划培育项目和广州国家实验室项目等经费支持。暨南大学博士生肖潺潺、博士后任之尧、博士生张蓓、博士生茅立鹏、广州市老年医院朱国栋教授为共同第一作者。暨南大学陈国兵教授、罗钧洪教授、梁晓峰教授,王鹏程副教授为共同通讯作者。暨南大学是论文的第一完成单位。
专家点评一:刘光慧(中国科学院动物研究所研究员)
衰老人群的免疫防御功能下降,从而对新发和再发传染病的防御力较差,这一点在近两年的新冠大流行中已经充分体现。新冠肺炎的重症和死亡病人多为高龄老人。因此,有必要深入了解老年群体针对新冠病毒的免疫应答特点,包括接种新冠疫苗之后的免疫保护作用。
陈国兵教授领衔的多团队合作,在前期成熟的 T 细胞免疫应答研究相关材料和平台基础上,全面筛选了新冠病毒的 CD8 T 细胞优势表位。以年轻和老年灭活疫苗接种队列为研究对象,系统评估了疫苗接种前后抗体和细胞免疫应答变化。最后通过新冠病毒抗原特异性 TCR 免疫组学和人工智能机器学习分析,阐明了老年人接种新冠病毒灭活疫苗后免疫功能变化的分子机制。除了免疫细胞的基因表达变化之外,老年人体内免疫细胞组库多样性的减少、接种疫苗后抗原特异性克隆型扩增能力较弱是影响老年人接种疫苗后效率低于年轻人的重要原因。虽然该研究聚焦于新冠病毒灭活疫苗,但也可能揭示了老年人对外界抗原(包括新发和再发感染性病原微生物和各类疫苗等)免疫应答不佳的一种通用机制,即抗原特异性免疫受体组库的不足可能是老年人罹患各种新发/再发传染病及对疫苗接种效果不佳的重要原因。该研究工作是陈国兵团队继 2022 年在 Nature Aging 发表的增龄和衰弱人群免疫细胞单细胞图谱工作之后的又一重要成果,不仅阐明了衰老导致的新冠病毒灭活疫苗应答不佳的分子机制,也为未来针对老年人的疫苗设计和/或疫苗接种策略优化提供了数据和理论基础。
专家点评二:赵金存(教授,广州医科大学呼吸疾病国家重点实验室主任)
新冠疫情仍在全球流行,对于全球经济和人类生命健康都带来巨大影响。随着我国疫情防控政策调整及社会经济生活恢复常态,人们可能认为,新冠疫情时代已经结束。但是由于新冠病毒变异株的不断涌现,引发了疫情是否会卷土重来的担忧。特别是对于老年人以及部分基础病的患者而言,感染了新冠病毒后,免疫应答如何变化,是否会发生再次感染?这些都是亟待回答的科学问题。
相对于年轻人,老年人接种新冠灭活疫苗的效果可能不够理想,而新冠的突变体对于接种疫苗后突破感染还存在很多未知数,且导致老年人疫苗应答受损的分子机制仍未知。暨南大学陈国兵教授领衔多个团队合作揭开了这个谜底。他们团队招募了 121 名年轻人和 48 名老年人接种我国科兴和国药这两种灭活疫苗的人群队列,研究发现,在抗体产生上,老年人拥有更慢的抗体产生速度,对于灭活疫苗的响应比较迟缓。进一步,他们利用相应的 T 细胞免疫检测手段,发现相比于年轻人,老年人 T 细胞应答更低。接着他们利用 TCR 免疫组库和单细胞测序技术揭示,很可能是由于老年人体内的 BCR 和 TCR 的多样性不足引起的这种现象。此外,该研究使用人工智能技术分析抗原特异性 TCR 是一个重要的技术创新。对单个表位抗原特异性 TCR 特征的提取和总结一直是个难题。该研究基于单细胞技术解析 6 种不同新冠病毒变异株抗原表位特异性 TCR 组库,利用多种人工智能分析方法,从 bulk cell 的 TCR 序列中精准地提取出抗原表位特异性 TCR 序列。为未来抗原表位特异性 TCR 特征的相关研究提供了一个新范式。
综上,这项研究首次阐明了接种我国新冠病毒灭活疫苗的老年人的免疫应答规律,以及新冠病毒变异对于老年人群 T 细胞免疫的影响和机制,为我国疫苗研发提供了新数据和新视角,也为我们在后疫情时代针对老年群体优化新发和再发病毒相关疫苗的接种策略提供了新的科学依据。
专家点评三:张存泰(教授、主任医师,同济医院老年科主任、中华医学会老年医学分会候任主委)
既往 mRNA 疫苗和腺病毒载体疫苗的临床试验已经表明,接种相关新冠病毒疫苗之后,老年人的抗体和 T 细胞反应较低,但是对于灭活疫苗接种者导致老年人疫苗应答受损的分子机制仍然知之甚少。而且在中国,大部分人群都是接种灭活疫苗,所以阐明其具体机制非常重要。暨南大学陈国兵教授领衔多团队的这个工作很好填补了年轻人和老年人接种灭活疫苗之后其免疫变化机制这个空白。
陈教授团队的工作从多个维度阐述了新冠病毒灭活疫苗接种后的免疫应答变化。除了中和抗体之外,工作更多聚焦 T 细胞免疫应答。除了比较老年人和年轻人的细胞免疫应答强度之外,还比较了病毒原始株和后续 13 种突变株的细胞免疫应答变化,研究结果证实老年人对新冠病毒变异株的细胞免疫应答不佳。在机制方面,除了利用分选的 CD4 T、CD8 T 和 B 细胞进行转录组分析之外,更是从免疫细胞受体组库角度揭示了免疫应答直接执行细胞的精准变化。基于这种抗原特异性免疫细胞在老年人体内的减少和功能变化,我们有理由相信,除了诱导主动免疫的疫苗接种之外,老年人可能更需要直接的被动免疫补充。
陈教授团队的工作不仅揭示了老年人疫苗应答不佳的分子机制,也提供了很多非常有价值的实验方法和科学数据。包括人工抗原递呈系统介导的抗原表位特异性 CD8 T 细胞扩增、CD8 T 细胞抗原表位鉴定、荧光标记 pMHC 四聚体制备等方法,也包括若干新冠病毒 CD8 T 细胞抗原表位的具体信息和表位特异性 TCR 的序列等,这些研究方法为深入理解冠状病毒发病机制、疫苗研发等提供了有效手段。
专家点评四:冷晓(约翰•霍普金斯大学医学院教授)
老龄化是新冠肺炎疾病进展、严重程度,尤其是临床结局的关键风险。据报道,SARS-CoV-2 感染后,老年人常出现严重症状和高死亡率。因此,分析老年受试者对 SARS-CoV-2 的免疫应答变化至关重要。而且在严重的新冠肺炎患者中,CD4 和 CD8T 细胞显著减少,更显示 T 细胞介导的免疫反应在 SARS-CoV-2 感染期间的重要性。尽管腺病毒载体新冠疫苗可以在老年人中诱导抗体和 T 细胞反应,但呈现低反应免疫水平。老年人接种灭活新冠疫苗后的免疫反应及其机制目前尚不清楚。
暨南大学老年免疫研究所陈国兵和罗钧洪等团队人员通过建立人工抗原递呈系统,通过各种抗原肽-MHC 四聚体(tetramer)的快速制备来标记抗原特异性 T 细胞、然后利用单细胞 TCR 多组学和人工智能机器学习分析,阐明了老年受试者体内表位特异性 T 细胞候选克隆数目低下是老年人接种灭活新冠疫苗后免疫反应不佳的主要原因。我认为该研究有以下多个亮点:1. 证明了 SARS-CoV-2 灭活疫苗接种在老年人中诱导了不同程度的适应性免疫反应、但跟年轻人比较则相对受损,并且细胞免疫更弱于抗体反应;2. 该研究是目前为止针对老年人对灭活新冠疫苗免疫应答表现及其机制最全面和深入的系统研究,揭示了导致老年人细胞免疫应答受损的机制:表位特异性 T 细胞克隆不足(基于表位特异性 TCR 库减少);3. 提供了非常重要的 SARS-CoV-2 相关科研资料。该研究鉴定了新冠病毒野生型和包括 omicron 在内的 13 种变异株中的所有优势表位,阐明 13 个 T 细胞抗原表位在变异株中突变后导致 T 细胞免疫反应下降,这些表位突变可能是导致免疫逃逸的原因之一,应在未来的新冠疫苗设计中尽力避免。也从配对的 TCR a 和 β 链中鉴定了数千个 SARS-CoV-2 特异性 CDR3 序列。这为新冠肺炎研究提供了另一个重要的研究资源,这些 TCR 可以进一步用于新冠的诊断和治疗。
综上所述,本研究揭示了衰老引起的新冠疫苗免疫应答受损的潜在分子机制,同时为老年人预防新冠重症肺炎需要优化疫苗接种策略提供了新的理论基础,是老年免疫和新冠疫苗研究进展中一个新的里程碑。