目前研究BBB功能障碍的方法是利用微血管、内皮细胞培养以及FACS分类细胞分离。但是这些方法有很大的局限性,如分离的微血管可能存在污染的NVU细胞,导致难以评估BBB功能障碍的细胞来源。培养的细胞,特别是内皮细胞的一个主要限制是去分化。限制了其用于体外功能渗透性研究。最近基于FACS的方法已被用于分离NVU不同细胞类型,如内皮细胞、周细胞、星形胶质细胞和小胶质细胞。然而其采用转基因小鼠与基因标记细胞进行分离和分选。大多策略是用野生型(WT)或基因标记的小鼠同时分离NVU的单一或最多两种细胞类型。方法较为繁琐以及昂贵,并可能引入伪影。
近日,来自德国法兰克福歌德大学的Kavi Devraj教授团队进行了基于流式细胞仪小鼠和人体组织中神经血管单元细胞同源分离方案的相关研究。研究成果以“A flow cytometry-based protocol for syngenic isolation of neurovascular unit cells from mouse and human tissues”为题于2023年03月01日发表在《Nature Protocols》上。本文基于FACS方案,建立称为 "EPAM-ia"的分离方式,可实现同时分离四种主要的NVU细胞类型,即内皮细胞、丰富的周细胞群(壁细胞和成纤维细胞的水平较低)、星形细胞和小胶质细胞。
由内皮细胞、周细胞、并列的星形胶质细胞和小胶质细胞以及神经元组成的神经血管单元(NVU)对于中枢神经系统的正常运作至关重要。NVU对血脑屏障(BBB)的功能起着关键性的调节作用,因此是一个关键的治疗目标。为了解BBB功能障碍程度和细胞来源,需要同时对NVU细胞进行分离和分析。在此,本文开发了EPAM-ia方法,该方法基于流式细胞仪,用于同时分离和分析内皮细胞、周细胞、星形细胞和小胶质细胞。该方法的基础是使用酶对NVU细胞类型进行不同的处理,对每种细胞类型进行特定机械匀浆和过滤,然后将其合并进行免疫染色和荧光激活细胞分选。分选策略包括细胞类型特异性和排除污染细胞的标记,以分离出主要的NVU细胞类型。对一或两只动物来说需要6小时。隔离部分需要有动物处理、新鲜组织处理和流式细胞仪免疫标记经验。分选的NVU细胞可用于下游应用,包括转录组学、蛋白质组学和细胞培养。然后可以用UpSet进行多种细胞类型分析,从与BBB功能障碍有关的神经系统疾病中单一或多种NVU细胞类型中获得相关目标。EPAM-ia方法也适用于分离其他几种细胞类型,包括癌细胞和免疫细胞,同时适用于小鼠和人类健康和病理组织等细胞类型分离。
01 EPAM-ia方法分离神经血管单元细胞概述
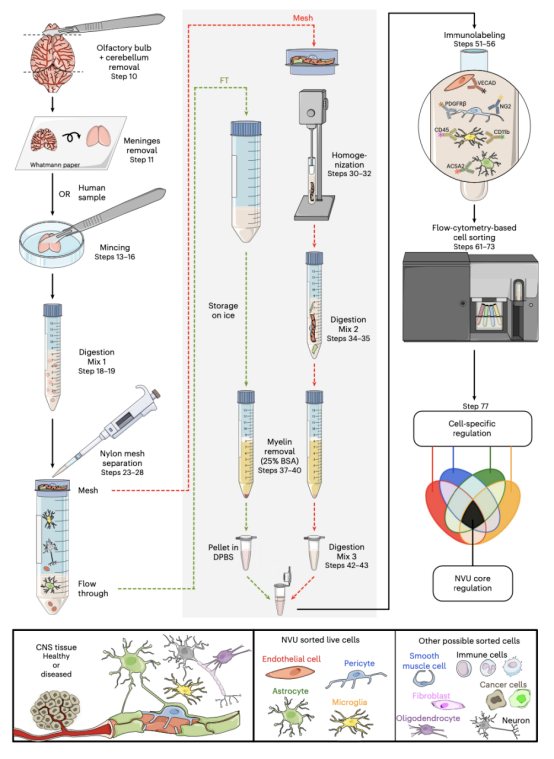
图1 用EPAM-ia方法从成年小鼠大脑中合成分离神经血管单元细胞流程
EPAM-ia方法主要包括两个主要步骤:细胞特异性解离,然后通过流式细胞仪分离和收集不同细胞类型。在第一次温和酶解后(步骤18-19),组织悬液过滤后得到非血管细胞(星形胶质细胞、小胶质细胞和其他神经/免疫细胞)(步骤23-28),而过滤网上的血管碎片进一步均质和消化以获得解离血管细胞(步骤30-43)。血管和非血管细胞悬浮液最后合并,然后通过流式细胞仪对每种细胞类型利用既定特异性标记进行分类,其中包括对污染细胞的排斥性标记,其门控策略包括多个荧光通道(步骤51-73)。最终确定门控策略后,本文优化了基于木瓜蛋白酶的第一个消化步骤。在消化混合物1中测试了不同浓度木瓜蛋白酶,其中含有0.001%的DNase1,将木瓜蛋白酶浓度从0.025%增加到0.05%与周细胞产量相关(分别为每106个活细胞8000个到19500个)。然而,较高浓度的酶所得到的内皮细胞、星形胶质细胞和小胶质细胞较少,用0.1%木瓜蛋白酶观察到较少的周细胞(壁细胞))。由于不同木瓜蛋白酶浓度下的死亡细胞数量相似,可以得出结论,当使用较多酶时,表面表位会丢失。因此,本文使用含有最低浓度木瓜蛋白酶的消化混合物1(0.025%)。其中还包括25%的BSA梯度,用于去除髓鞘。本方式其中包括组织解离程序和FACS策略来分类NVU细胞类型,也适用于单个小鼠大脑。
02 NVU细胞差异化处理
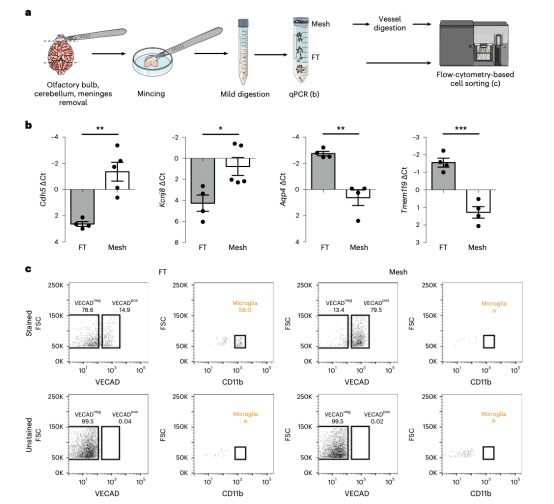
图2 用尼龙网过滤分离血管细胞和胶质细胞,对NVU细胞进行差异化处理
为了分离星形细胞,本文最初试图使用经典标记GLAST1(也称为星形细胞细胞表面抗原1(ACSA1),基因名Slc1a3)。然而门控策略中没有保留这个目标,因为这个表位已知对用于分离神经细胞的几种酶敏感。此外,ACSA1只对细胞悬浮液的一部分进行染色,该悬浮液是用星形细胞细胞表面抗原2(ACSA2)磁珠预选,另一个星形细胞标记物由Atp1b2基因编码的ACSA2在星形胶质细胞中高度表达,与ACSA1相比更为广泛。因此选择ACSA2对星形细胞进行标记。为了测试这种抗原,使用神经组织分离试剂盒,用木瓜蛋白酶的单步消化方案来分离神经细胞。我们用ACSA2抗体对细胞悬液进行染色,观察到两个具有高和低反应性的群体。通过qPCR发现ACSA2高群体是星形细胞群体,因为他们有较少内皮细胞(血管内皮粘连蛋白或Cdh5/VE-cadherin,和Claudin-5或Cldn5)和较多的星形细胞(aquaporin-4或Aqp4,和胶质纤维酸性蛋白或Gfap)标记表达。该群体也表达大量壁细胞标志物。
为了消化细胞外基质,本文增加了两个额外的消化步骤,在用含有木瓜蛋白酶的温和消化混合物1孵化后,接着用10微米的网眼过滤样品,将血管碎片与单细胞分开。采用的网眼大小是一个关键步骤,根据微血管的大小(5微米和10微米之间)来选择。通过qPCR,确认了内皮细胞(Cdh5)和周细胞主要存在于网状结构的顶部,而星形胶质细胞(Aqp4)和小胶质细胞则在流经处。当后者储存在冰上时,网状顶部的血管碎片经历用于脑内皮细胞原代细胞培养的严格均质化和苛刻消化混合2和3步骤。对FT和网状悬浮液进行分类时,通过流式细胞仪对小胶质细胞(CD45low/ CD11bpos)和内皮细胞(CD45neg/VE-cadherinpos)进一步确认胶质细胞和血管细胞的分离。
03 EPAM-ia方法在脑梗、肿瘤、人脑NVU细胞分离中的应用
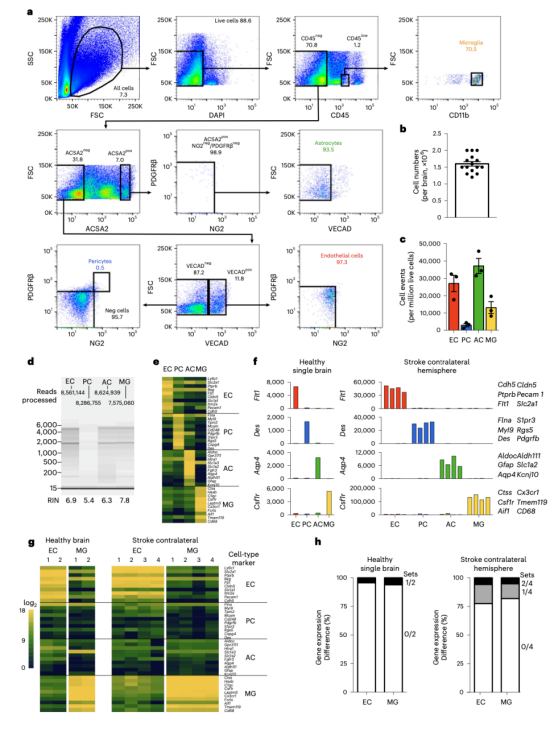
图3 最终EPAM-ia方法在单脑上门控策略以及与小鼠中风模型对照样本纯度比较
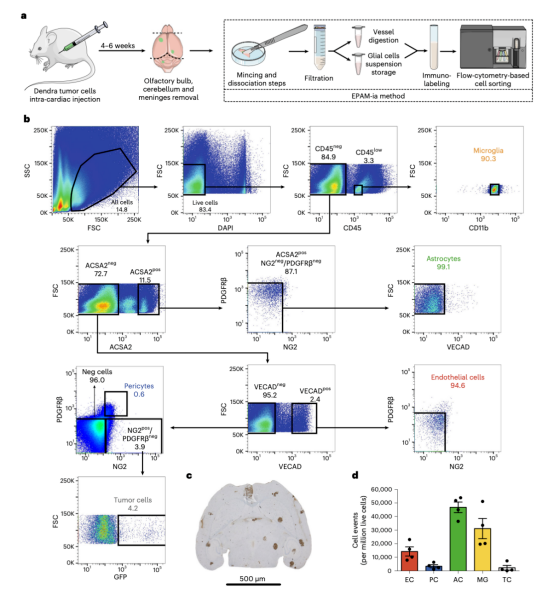
图4 基于EPAM-ia方法NVU和肿瘤细胞的分离应用于脑转移动物模型
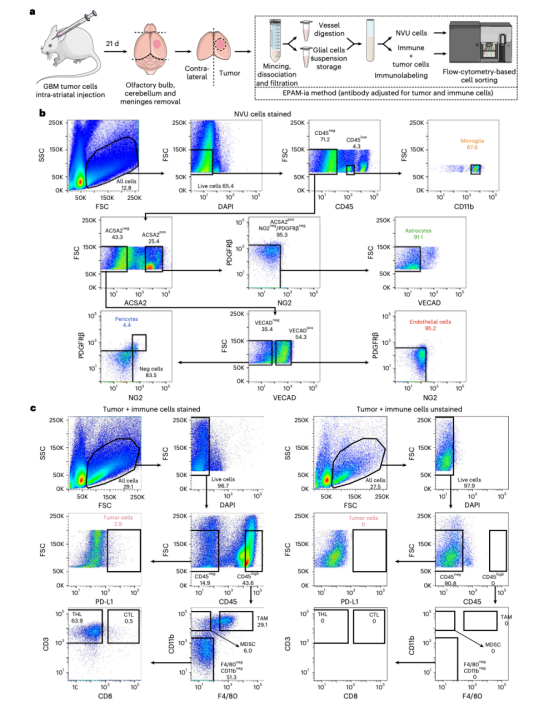
图5 FACS图显示在小鼠胶质母细胞瘤模型脑组织中分离NVU细胞以及免疫和肿瘤细胞门控策略
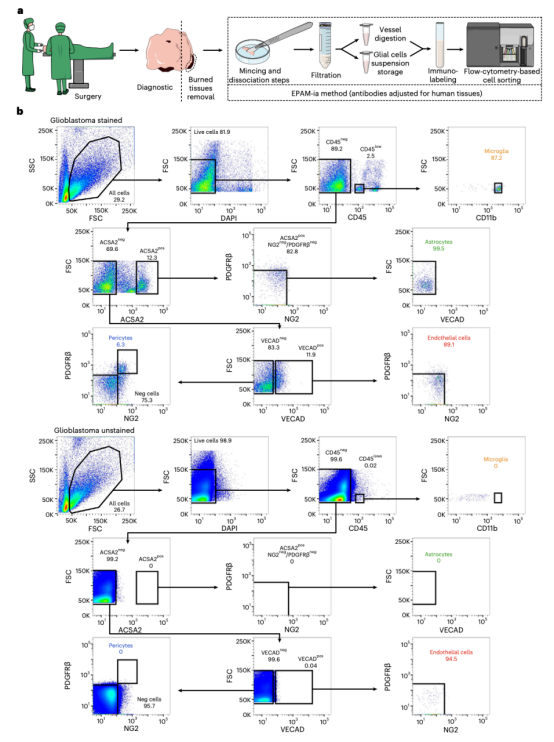
图6 FACS图显示使用EPAM-ia方法从人脑组织中分离NVU细胞门控策略
接着研究人员成功将EPAM-ia方法应用于中枢神经系统疾病小鼠模型的健康和病理组织,包括中风、癌症和阿尔茨海默病。对于实验性小鼠脑部黑色素瘤转移的癌症模型,除了NVU细胞外,脑转移的肿瘤细胞也能被有效分离和分选。样品制备不会改变其他细胞类型,因为免疫细胞和癌细胞也可以从小鼠胶质母细胞瘤模型大脑中成功分离出来。虽然动物模型为NVU细胞在神经系统疾病中病理生理机制提供了宝贵见解,但这些数据并不总是能转化为临床价值。因此,迫切需要对人类患者活检的NVU细胞进行持续研究,以评估疾病部位和严重程度,并建立新的治疗策略。EPAM-ia方法转化价值体现在它成功应用于几个来自肿瘤和癫痫患者的人脑活检标本,几乎没有对抗体组合调整。将EPAM-ia方法应用于中枢神经系统疾病NVU细胞,然后进行下游RNA测序(RNA-seq)、蛋白质组学研究和生物信息学分析,可以更好地理解几种神经系统疾病的病理生理学,包括中风、阿尔茨海默病、脑肿瘤和癫痫,最终建立新的有效的治疗目标。
04 EPAM-ia方法后下游处理和分析示意图
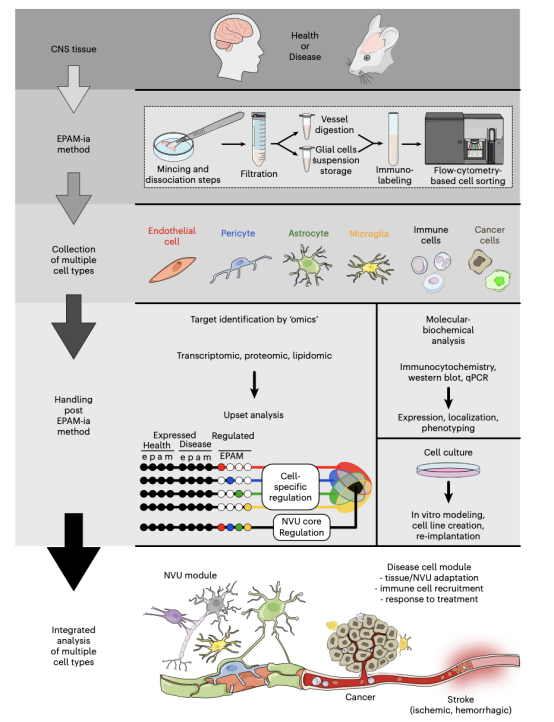
图7 EPAM-ia方法及下游处理和分析示意图
总之,本文EPAM-ia方法可以同时分离小鼠和人类中枢神经系统组织的内皮细胞、周细胞、星形细胞和小胶质细胞。该策略不仅适用于分离健康和转基因动物中NVU,也适用于神经系统疾病的动物模型和人类标本。此外,该方案可用于分离其他类型的细胞,如在小鼠脑转移模型中分离移植黑色素瘤肿瘤细胞或小鼠胶质母细胞瘤模型中分离免疫和肿瘤细胞。采集细胞已被证明可用于多种应用,其中包括qPCR分析和RNA-seq,也可考虑用于蛋白质组学分析或细胞培养。使用EPAM-ia产生的NVU细胞类型表达数据库将有助于揭示特定生理或病理条件下细胞特异性和核心调节基因。通过从同一样品中分离分析癌症和免疫细胞以及NVU细胞类型,对研究肿瘤微环境有特别价值。因此,EPAM-ia方法可以通过下游Upset分析适用于一些神经系统疾病,有可能产生新的和强大的治疗位点。EPAM-ia方法提供了一个独特的工具,可以同时从小鼠或人类中枢神经系统组织中分离出NVU的细胞成分和其他多种细胞类型。为血脑屏障研究提供一种新的思路,助力脑类器官以及穿透血脑屏障药物递送研究进展。







