导语:T细胞是免疫系统能够长期监视和清除癌变细胞的主要成员之一。在人类T细胞受体(TCRs)的帮助下,T细胞可以识别外来入侵和肿瘤细胞。如果T细胞通过TCR发现肿瘤细胞有异常,就能实现特异性活化和增殖,并释放物质,杀伤肿瘤细胞。为了增强T细胞的识别能力,TCR基因以多种可能的方式进行重组(重排),以产生不同的TCR,这些TCR可以识别广泛多样的外来抗原。TCR基因的高变异解释了人与人之间免疫能力强弱之分的部分原因。那么,人类进化至今,不同人种的TCR基因变异至什么程度了?
TCR:帮T细胞识别肿瘤的“信号天线”
T细胞作为机体适应性免疫的主力军,可以攻击病原体感染细胞和肿瘤细胞,在维持机体稳态中发挥作用。T细胞按表面分化抗原(CD)的不同,可分为CD8+和CD4+两大亚群。CD8+又称为杀手T细胞,细胞表面有CD8分子,识别MHCⅠ类分子所提呈的内源性抗原肽,活化后主要分化为CTL,杀死病毒感染的细胞或癌细胞;CD4+又称为辅助T细胞,细胞表面有CD4分子,识别MHCⅡ类分子所提呈的外源性抗原肽,活化后主要分化为Th,可辅助CD8+发挥作用。
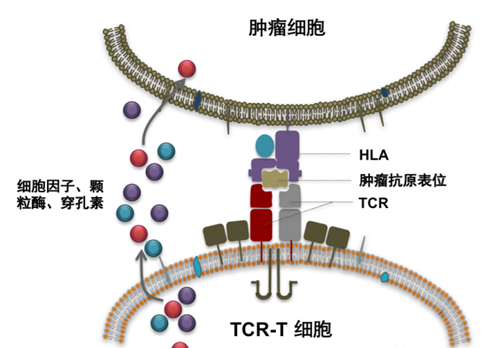
图1 T细胞抗肿瘤原理(图源:[1])
T细胞可通过其表面的TCR识别抗原(细菌、病毒和受感染或癌变的体细胞表面的小蛋白片段),并由主要组织相容性复合体(MHC)分子(在人体内被称为HLA)递呈抗原多肽,激活T细胞,进入后续的免疫应答过程。如果T细胞通过TCR发现肿瘤细胞有外源病毒或者因基因变异产生的蛋白片段,就能实现特异性活化和增殖,并进一步释放颗粒酶、穿孔素和相关细胞因子杀伤肿瘤细胞,这是正常机体的免疫系统能够长期监视和清除癌变细胞的主要机制之一[2](图1)。
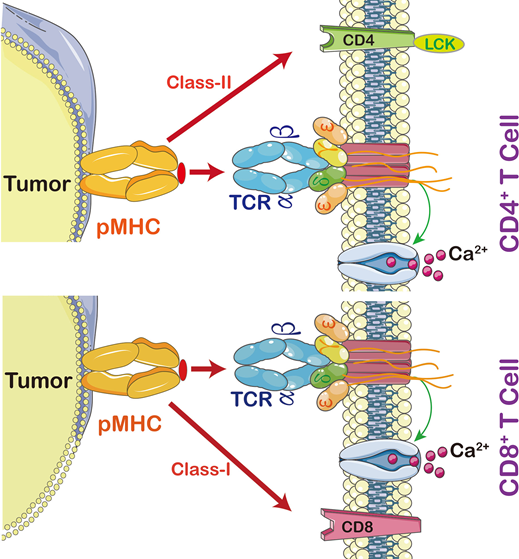
图2 T细胞与MHC相互作用(图源:[2])
人类基因组中有4个TCR基因,两个编码轻链TCR:TRA基因编码TCRα,TRG基因编码TCRγ;两个编码重链TCR:TRB基因编码TCRβ,TRD基因编码TCRδ。重链TCR和轻链TCR形成异源二聚体,组成完整的TCR。在人类中存在两种TCR:αβTCR和γδTCR,其中αβTCR在95%的T细胞表达,主要参与识别MHC分子上呈递的抗原,称为αβT细胞;γδTCR在5%的T细胞表达,具有更广泛的抗原识别能力,可以直接识别某些非MHC限制的抗原,称为γδT细胞。
TCR基因:携带免疫系统进化信息
了解人类免疫系统组成部分的变异对于疾病易感性、预后和人群历史的研究非常重要。受限于技术发展,迄今为止发现的大部分遗传变异都归因于MHC位点。能够准确评估编码T和B细胞受体等位基因变异的技术,仅在最近才得到开发和应用。因此,许多人类群体在免疫遗传变异参考数据库中的代表性严重不足,人类TCR基因的多态性仍需要进一步研究。
类似于免疫球蛋白基因,TCR基因也包括可变(V)、多样性(D)和连接(J)基因序列,它们在T细胞发育过程中重组成功能性的TCR,具有多样的结合潜力。然而,由于功能性和非功能性基因序列的相似性,TCR基因的变异识别受到短读测序技术的限制,因此目前对于TCR基因的变异了解仍较有限。
2月15日,Immunity发布了瑞典卡罗林斯卡医学院研究团队针对多个人类种群TCR基因变异的深度测序,以确定人类TCR基因的可变性有多大。通过采用Rep-Seq技术结合IgDiscover对血液样本进行深度测序,研究人员检查了来自撒哈拉以南非洲、东亚、南亚和欧洲的45人的TCR基因,确定TCRα(TRA)、β(TRB)、γ(TRG)和δ(TRD)等位基因变体,并从四个基因位点组装一个人类TCR V、D和J种系基因数据库,确定不同人群之间频率不同的等位基因;进一步分析了来自五对同卵双胞胎的可公开获得的TCR Rep-seq库,探索新的等位基因;将现代人类基因与古人类基因进行比较,探索新引入的基因组片段。
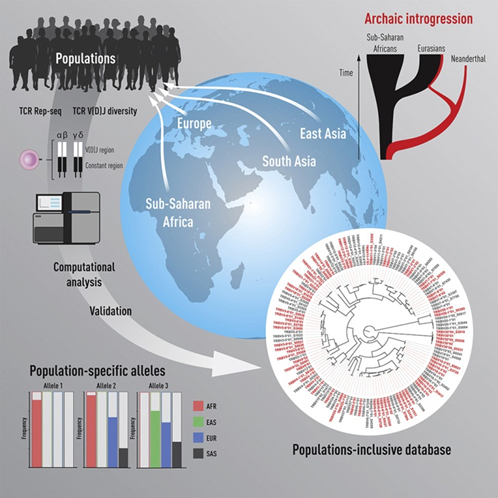
图3 研究的图形概要(图源:[3])
他们发现:除了同卵双胞胎之外,每个人都有一组独特的TCR基因变异体;发现175个新的基因变异,使已知TCR基因变异的数量增加一倍,这为基因型数据库的构建提供了依据;现代人类存在几个外源性基因片段,某些基因变异起源于尼安德特人,其中一种变异存在于高达20%的欧洲和亚洲现代人身上,这表明了人类基因组在演化过程中的变异和进化。总之,该研究提供了一个更全面和深入认识人类TCR基因多态性的方法,为人类TCR基因型的变异数据库建立提供了参考。
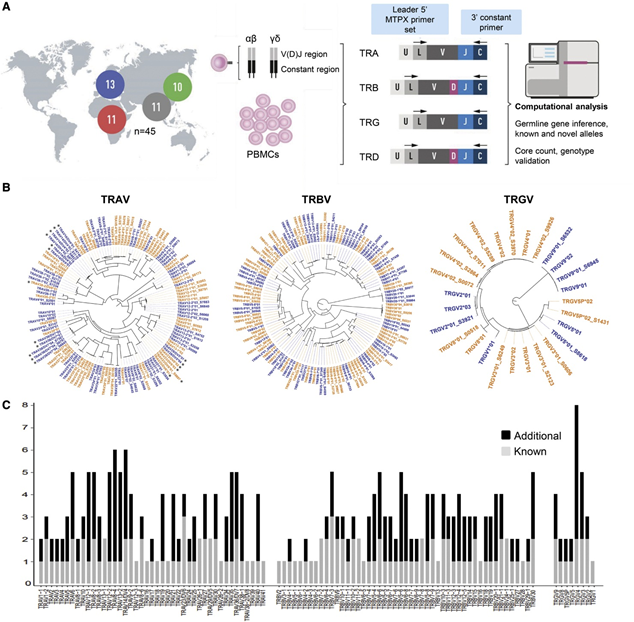
图4 TCR数据库建设(图源:[3])
本研究仍有一些不足之处:首先,这项研究基于不同人群的45个个体的TCR基因型分析,虽然这足以确定每个人群中的常见变异,但更稀有的TCR变异可能会被忽略;其次,本研究使用的表达基因推断方法也无法揭示如伪基因之类的未表达TCR基因;再者,扩展分析可以包括来自东南亚或美洲的其他人群,还可以利用基因组分析来补充本研究;最后,本研究需要使用高覆盖率的古人类基因组,但目前仅有四个。随着我们对古人类基因变异的认识不断扩大,可能会发现更多的嵌合TCR等位基因。
研究作者Martin Corcoran表示:“我们发现,除了同卵双胞胎之外,每个人都有一组独特的 TCR基因变异体。这些差异揭示了在人群水平上观察到的对感染和疫苗差异反应背后的可能机制。使用全基因组测序中使用的标准方法无法检测到这些基因的变异,但随着专门的深度测序方法和分析软件的发展,可以高度精确地定义B细胞和T细胞受体基因。由于这些基因是我们基因组中变化最大的基因之一,可反馈出有关免疫系统在历史进程中如何发展的新信息。我们对从尼安德特人祖先那里继承来TCR变体的功能特别感兴趣。”
研究通讯作者Gunilla B. Karlsson Hedestam表示:“了解人类遗传学是开发靶向治疗的基础。研究中描述的方法提供了新的机会,尤其是在癌症领域,T细胞是几种有前途的免疫疗法的核心。这些发现可能会在包括精准医学在内的一系列医学学科中,推动新的诊断和疗法的发展。我们现在正在研究几个新发现的基因变异的功能意义,以及这种变异如何影响我们的T细胞反应。我们还计划进行涉及大量个体的扩展研究,以检验TCR基因变异在已知涉及T细胞的疾病中的作用,例如传染病、癌症和自身免疫性疾病。
参考资料:
[1]谢兴旺.TCR创新药:未开垦的处女地[J].张江科技评论,2021(06):42-44.
[2]Zhao Q, Jiang Y, Xiang S, et al. Engineered TCR-T Cell Immunotherapy in Anticancer Precision Medicine: Pros and Cons. Front Immunol. 2021 Mar 30;12:658753. doi: 10.3389/fimmu.2021.658753. PMID: 33859650; PMCID: PMC8042275.
[3]Martin Corcoran, Mark Chernyshev, Marco Mandolesi, et al., Archaic humans have contributed to large-scale variation in modern human T cell receptor genes, Immunity (2023), https://doi.org/10.1016/j.immuni.2023.01.026







