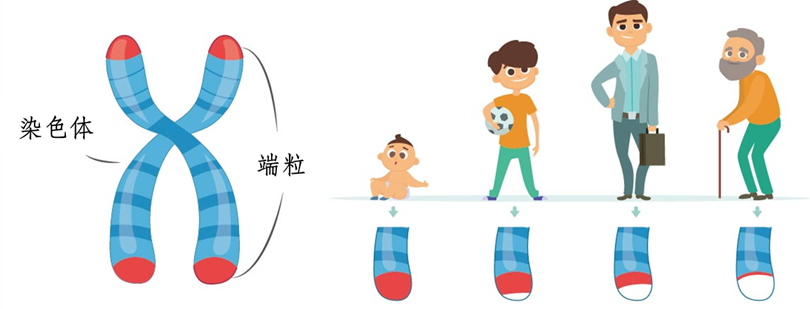
导语:端粒是染色体两端的“帽子”,好比鞋带尾部的塑料头,保护染色体不被降解和散开。随着年龄的增长,细胞分裂次数增加,端粒逐渐消耗,长度缩短。当端粒短到无法再保护染色体免受损坏的程度时,基因组变得不稳定,细胞启动静默或死亡程序。这个程序可杀死端粒不稳定和癌症相关染色体畸变的细胞,这类细胞往往会逃避端粒控制的增殖限制,实现“永生”(癌变)。端粒会在“力竭”前,与细胞的“发电厂”(线粒体)进行“交流”,通过“核爆”(炎症反应),启动“自毁”程序,杀死可能癌变的细胞。
端粒:以我的长短,护细胞的岁月静好
端粒位于真核细胞染色体的末端,与端粒结合蛋白一起构成特殊的“帽状”结构,保持染色体的完整性和控制细胞分裂周期。其实质为一小段DNA-蛋白质的复合体。根据DNA复制的机制及特点,每次染色体复制后,延伸链上的DNA末端必有一小段无法被复制。所以,细胞每分裂一次,端粒缩短30 bp-200 bp,当其缩短到2 kb-4 kb(危机长度)的特定临界值时,细胞将会进入静默期或者启动凋亡机制。因此,端粒长度与细胞老化有明显的关系[1]。
但是,人体的部分细胞,例如精原母细胞、肿瘤细胞等,含有端粒酶,能在DNA末端接上新的端粒片段,使端粒维持在一个稳定的长度,且不会随着分裂次数增加而缩短,从而实现细胞的快速增殖及永生化。相对于正常体细胞,肿瘤细胞的端粒一般较短。尽管在85%-90%的肿瘤中都能够检测到端粒酶的活性,但端粒酶并不是导致细胞癌变的直接原因,而是在肿瘤生长和增殖过程中具有决定性的作用。因此,端粒酶的激活发生在癌变之后(当第一个肿瘤细胞已经产生),端粒酶使得肿瘤细胞变得不朽,并能够无限分裂增殖[2]。
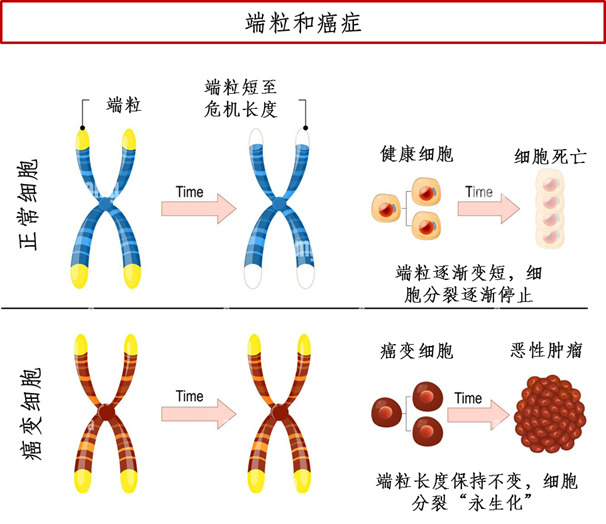
图1 端粒和癌症的关系简图(制图:生物探索编辑团队)
2009年诺贝尔生理学或医学奖授予在端粒和端粒酶研究领域有突出贡献的Elizabeth Helen Blackburn等3位科学家,以表彰他们发现了端粒和端粒酶保护染色体的机制。从此,端粒与端粒酶的研究在肿瘤领域受到越来越多的关注,尤其是阻断端粒延长机制以及端粒酶抑制剂等可能成为潜在的抗肿瘤治疗新靶点[3]。
端粒是如何预防癌症形成的?
端粒长度的缩短,使得细胞的基因不稳定性增加,因此容易发生基因突变等异常情况,使得肿瘤发生风险增加。一旦产生肿瘤细胞,肿瘤细胞因端粒酶的作用,使端粒“异常”的稳定在一定长度,实现永生。要维持机体的平衡,端粒需要在自然缩短和维稳之间找到一个平衡点,防止癌症的形成。那么,端粒是如何把控这个平衡点的?
2019年,美国加利福尼亚州索尔克生物研究所Jan Karlseder研究团队发现端粒处于危机长度的细胞会通过自噬过程被清除,在该过程中,身体会自行清除受损细胞。这种有益的自然过程去除了端粒非常短和基因组不稳定的细胞,是防止癌症形成的强大屏障[4]。但是,在端粒极短的危机期间,自噬依赖性细胞死亡程序是如何被激活的仍不得而知。
2023年,研究端粒生物学以及端粒如何预防癌症形成的Jan Karlseder团队联手研究线粒体在人类疾病、衰老和免疫系统中作用的Gerald Shadel团队共同对上述问题进行了探索。他们通过使用人类皮肤成纤维细胞进行基因筛选,发现了相互依赖的免疫感应和炎症信号通路(类似于免疫系统对抗病毒的通路),这种通路对于危机期间的细胞死亡至关重要。具体来说,他们发现来自短端粒的RNA分子以一种独特的方式激活了线粒体外表面名为ZBP1和MAVS的免疫传感器。
图2 研究成果(图源:[5])
当端粒变得非常短时,它们会与细胞的“发电厂”——线粒体进行通信。这种交流会触发一组复杂的信号通路,并引发炎症反应,从而破坏可能癌变的细胞。这些发现证明了端粒、线粒体和炎症之间的重要联系,并强调了细胞如何绕过危机长度,在通路功能不正常时发生癌变。可能会带来预防和治疗癌症的新方法,以及设计更好的干预措施来抵消衰老的有害后果[5]。
Shadel表示:“端粒、线粒体和炎症是衰老的三个标志,它们最常被单独研究。我们的研究结果揭示了一种端粒介导的肿瘤抑制机制,表明受压的端粒会向线粒体发送RNA信息以引起炎症。这凸显了研究这些标志之间的相互作用以充分了解衰老并可能进行干预以延长人类健康寿命的必要性。”
Jan Karlseder团队的高级研究员 Joe Nassour表示:“癌症的形成不是一个简单的过程,而是一个多步骤的过程,需要在整个细胞中进行许多改变和变化。更好地了解连接端粒和线粒体的复杂途径可能会在未来促进新型癌症疗法的发展。”
极短的端粒、线粒体和先天免疫之间具有协同作用,这种协同作用已经进化到可以防止人类发生与年龄相关的癌症。接下来,科学家们计划进一步研究这些通路的分子基础,并探索靶向这些通路预防或治疗癌症的治疗潜力。
参考资料:
[1]Blackburn EH, Epel ES, Lin J. Human telomere biology: A contributory and interactive factor in aging, disease risks, and protection. Science. 2015 Dec 4;350(6265):1193-8. doi: 10.1126/science.aab3389. PMID: 26785477.
[2]Shay JW. Role of Telomeres and Telomerase in Aging and Cancer. Cancer Discov. 2016 Jun;6(6):584-93. doi: 10.1158/2159-8290.CD-16-0062. Epub 2016 Mar 30. PMID: 27029895; PMCID: PMC4893918.
[3]Sugarman ET, Zhang G, Shay JW. In perspective: An update on telomere targeting in cancer. Mol Carcinog. 2019 Sep;58(9):1581-1588. doi: 10.1002/mc.23035. Epub 2019 May 6. PMID: 31062416; PMCID: PMC6692182.
[4]Nassour J, Radford R, Correia A,et al. Autophagic cell death restricts chromosomal instability during replicative crisis. Nature. 2019 Jan;565(7741):659-663. doi: 10.1038/s41586-019-0885-0. Epub 2019 Jan 23. PMID: 30675059; PMCID: PMC6557118.
[5]Nassour, J., Aguiar, L.G., Correia, A. et al. Telomere-to-mitochondria signalling by ZBP1 mediates replicative crisis. Nature (2023). https://doi.org/10.1038/s41586-023-05710-8.







