生殖遗传是生物学研究的一个重要方向,一直以来,科学家们都试图打破传统的生命孕育过程,为存在生育问题的患者带来治疗希望。问题在于,生殖细胞仅在生殖器官的特定环境中发育,而这个过程又极其复杂,因此体外重现该过程困难重重。
当地时间7月15日,日本九州大学的干细胞生物学家Katsuhiko Hayashi的研究团队在《Science》报告了一项开创性的研究进展。他们开发了一种培养系统,能够在体外环境中将小鼠多能干细胞构建为功能性卵巢卵泡,并且在该环境中原始的生殖细胞能够受精并孕育出幼鼠。
DOI:10.1126/science.abe0237
早在2011年,Katsuhiko Hayashi所在的团队就实现了通过体外诱导胚胎干细胞(ESCs)和诱导性多功能干细胞(iPSCs)形成原始生殖细胞样细胞(PGCLCs)的技术,经过进一步分化,这些细胞在植入不能生育的雄性小鼠体内后,能够生成功能正常的精子,并进一步孕育出健康且具有生殖能力的小鼠。
5年后,Katsuhiko Hayashi又和另一个团队一起带来了可以受精的“人造卵子”。但问题在于,在正常的卵子发生过程中,原始的卵母细胞需要在有体细胞的卵巢中才能逐渐发育成成熟的功能性卵母细胞。而这些经实验室培养得到的生殖细胞,必须需要回到动物体内进一步发育,才能够发挥进一步的功能。
在这项新的研究中,Katsuhiko Hayashi显然已经找到了克服这一问题的方法。
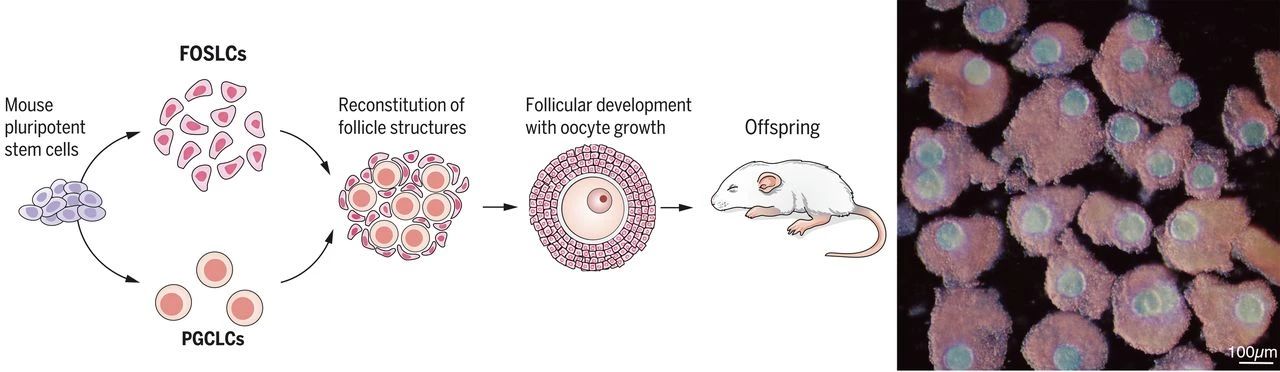
完全从小鼠多能干细胞重建卵泡结构,包括卵母细胞
首先,研究人员通过关注一系列化学成分,诱导了mESCs经历胚胎卵巢发育所必须的新生中胚层、中间中胚层和和生殖嵴部位的体腔上皮状态,逐渐分化为表达Nr5a1的胎儿卵巢体细胞样细胞(FOSLCs)。值得说明的是,Nr5a1是性腺体细胞的代表性标记基因,并且基因分析表明FOSLCs与胚胎卵巢体细胞的转录图谱相似。
这些情况是否意味着,经mESCs发展而来的FOSLCs具备与体细胞相同的功能呢?为了探究这一点,研究人员将FOSLCs与PGCLCs共培养,发现PGCLCs在共培养的第7天时进入减数分裂,从而分化为带有SYCP3蛋白排列的卵母细胞,在第11天时形成表达“变性基因”Foxl2的细胞结构,并最终发育为有功能的卵子,而FOSLCs则进化为卵巢卵泡结构。
神奇的是,如果将人工培育而成的卵子进行体外受精,并将体外培养后得到的受精卵植入到雌性小鼠体内,最终将有一部分胚胎转化为健康、有生育能力的后代小鼠。
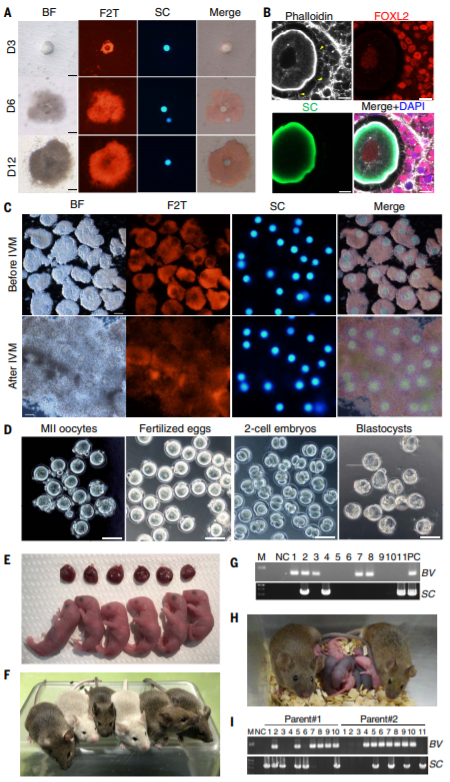
受精卵培育和发育过程
总之,这项新研究带来了一个使用干细胞从头开始创造卵子的系统,这将丰富人们对性腺发育的理解,并为研究和繁殖提供另一种配子来源。报告的最后,研究人员还表示,这一系统有望成为解决生殖生物学和再生医学关键问题的重要工具。
当然,尽管这一成果令人振奋,但是其中涉及到诸多伦理问题,在人体中应用仍然为时尚早。不过,研究人员希望,能够继续在合理合法的基础上探索该系统,从而有朝一日为不孕不育患者,甚至是同性恋群体,带来迎接新生儿的喜悦。
参考资料:
[1]https://medicalxpress.com/news/2021-07-viable-mice-eggs.html
[2]https://science.sciencemag.org/content/373/6552/eabe0237
[3]https://phys.org/news/2016-10-scientists-mouse-eggs-stem-cells.html