众所周知,肿瘤消耗葡萄糖的速度很快。早在1922年,德国生理学家、诺贝尔奖获得者Otto Warburg就提出,癌细胞快速扩张时会大量消耗葡萄糖,但是与氧化磷酸化这正常的产能方式相比,癌细胞选择的却是更“低效”的糖酵解形式,导致大量的葡萄糖能源被浪费。这一假说后来成为癌症代谢领域的经典理论。
然而,美国范德堡大学的研究人员最近带来的一项报告却颠覆了这个百年来被人们奉为圭臬的理论。他们发现,癌细胞其实是背上了“败家”的“黑锅”,真正大量消耗葡萄糖的其实是肿瘤微环境中的非癌细胞,谷氨酰胺才是癌细胞摄入最高的营养来源。
这项报告以Cell-programmed nutrient partitioning in the tumour microenvironment为题发表在4月7日的《Nature》上。

https://doi.org/10.1038/s41586-021-03442-1
氟代脱氧葡萄糖(18F-FDG)是21世纪最重要的影像学检查PET/CT最常用的显像剂,能够准确反映体内器官/组织的葡萄糖代谢水平。
在这项试验中,研究人员首先使用18F-FDG PET探测了结直肠癌、肾癌和乳腺癌等不同肿瘤小鼠模型中的葡萄糖摄取量,以量化肿瘤微环境中不同细胞群对葡萄糖的摄入情况。结果令人惊讶,葡萄糖优先被分配给了浸润性免疫细胞,而非癌细胞。
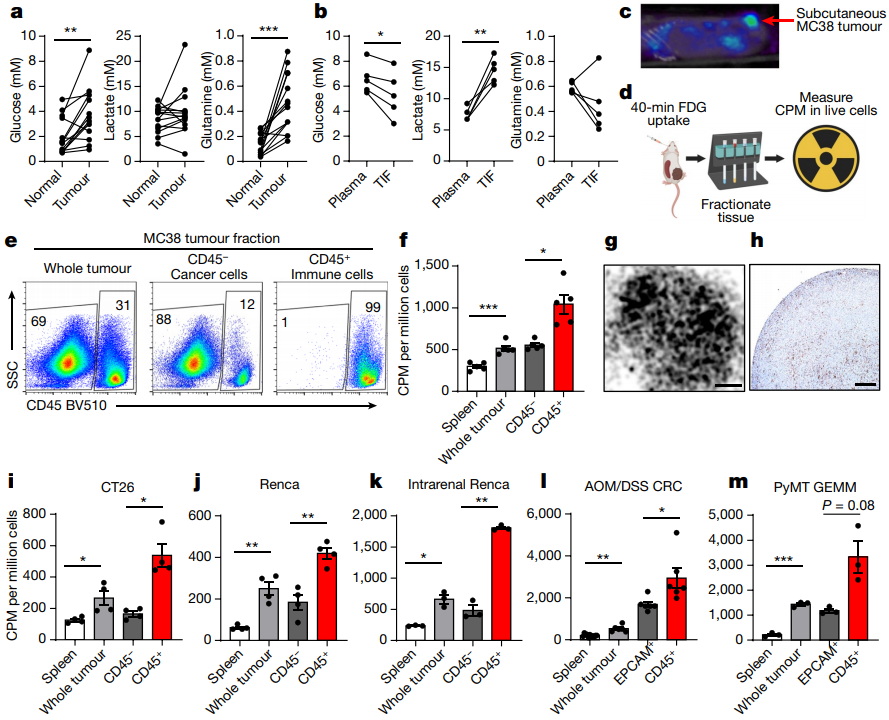
葡萄糖优先被免疫细胞而不是癌细胞消耗
微珠细胞分离分析显示,与癌细胞及其他免疫细胞相比,CD11B+髓样细胞表现出更强的FDG摄取能力,细胞外通量分析显示,肿瘤相关巨噬细胞(TAM,一种免疫细胞)以及单核样髓原抑制细胞(M-MDSCs)消耗的葡萄糖量最多,并始终保持着强大的葡萄糖代谢活性。
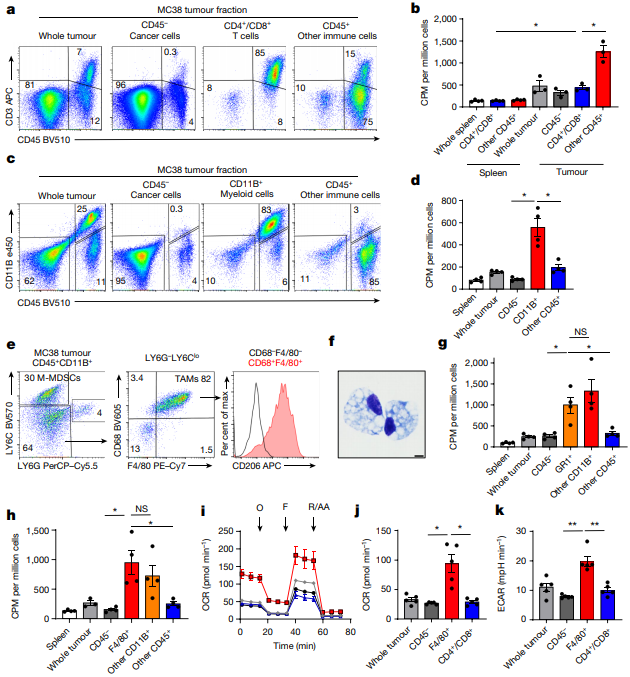
骨髓细胞比癌细胞吸收更多的葡萄糖
哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)信号通路是细胞内最主要的能量感受器。在这项研究中,研究人员观察到,骨髓细胞具有比癌细胞更高的磷酸化核糖体蛋白S6(pS6)水平,并且mTORC1通路的活性升高。这是否意味着,mTORC1可能在肿瘤微环境的葡萄糖摄取中发挥着作用呢?
为了解开谜题,研究人员连续4天对MC38肿瘤小鼠施用雷帕霉素,尽管处理后的小鼠在肿瘤大小、肿瘤微环境内葡萄糖和谷氨酰胺浓度方面保持不变,但是pS6水平、T细胞浸润、癌细胞和T细胞中的细胞增殖标志物Ki67水平明显降低,肿瘤相关巨噬细胞也显著变小,说明mTORC1在肿瘤微环境中调节着葡萄糖代谢。
不仅如此,研究人员还发现,谷氨酰胺和脂质以癌细胞消耗为主,并且mTORC1驱动的谷氨酰胺摄取过程可能会抑制癌细胞中糖酵解相关基因的表达和葡萄糖代谢。当谷氨酰胺摄入受限时,肿瘤浸润细胞会增加对葡萄糖的消耗。
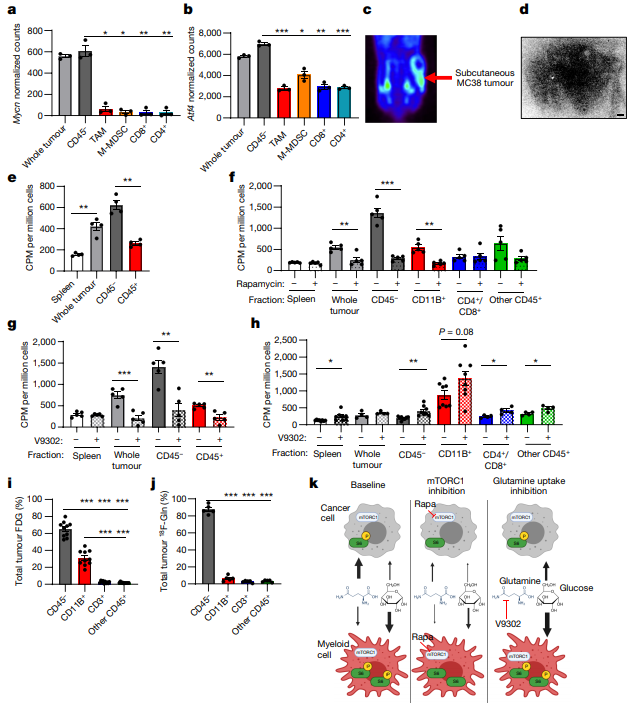
癌细胞摄取谷氨酰胺和脂质,抑制谷氨酰胺的摄取将促使癌细胞转而消耗葡萄糖
该报告的主要作者之一、医学博士Matthew Z. Madden说:“多年来,医学界一直认为是癌细胞更能掠夺葡萄糖,从而导致免疫细胞因缺乏能量而‘失职’。然而我们的研究颠覆了这一观点,不存在哪一类细胞摄入不足的情况,它们都在按程序摄取不同的营养素,谷氨酰胺和脂肪酸被分配给癌细胞,而葡萄糖则优先提供给免疫细胞。”
总之,这项研究揭示了肿瘤微环境内不同细胞群的营养摄取程序,这将有助于研究人员了解不同患者对癌症治疗的反应,并推动靶向特定类型细胞的新型癌症疗法的诞生。
参考资料:
1.Cell-programmed nutrient partitioning in the tumour microenvironment
2.Study revises understanding of cancer metabolism







