
吴玉章教授(图片来源:中国科学报)
这一研究于8月2日,发表在《自然》(Nature)杂志上。第三军医大学免疫学研究所吴玉章教授(Yuzhang Wu)、叶丽林(Lilin Ye)教授以及清华大学医学院祁海(Hai Qi)教授是这一研究的共同通讯作者。
研究背景
先前的研究发现,在急性病毒感染中,特异性CD8+T细胞能够通过分泌抗病毒细胞因子有效清除病毒。然而,在慢性病毒感染期间,病毒特异性CD8+T细胞却会进入功能“耗竭”的状态,表现较差的效应器功能,丧失记忆潜能。
实际上,这种功能“耗竭”CD8+ T细胞依然能够在慢性感染过程中控制病毒复制,使病毒维持在相对较低的水平,没有在短时间内爆发。目前,这背后的机制还知之甚少。
研究成果
发现重要CD8+ T细胞亚群
在这项研究中,科学家们发现,在淋巴细胞性脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus , LCMV)慢性感染的小鼠中,表达趋化因子受体CXCR5的eCD8+ T细胞亚群对控制病毒复制起到关键的作用。 这些CXCR5+CD8+ T细胞会优先定位于B细胞滤泡(B-cell follicles)中。
两类细胞表型和功能差异
研究人员比较了CXCR5+ 和CXCR5- CD8+ T细胞的表型和功能。引人注目的是,与CXCR5-亚群相比,CXCR5+CD8+ T细胞表达了更低水平的抑制性受体分子PD-1和 Tim-3,以及更高水平的刺激性分子KLRG1。
为了阐明两种细胞亚群在功能、状态等方面的差异,研究人员进行了RNA测序。结果发现,CXCR5+亚群与CXCR5-亚群的基因表达模式差异非常大。具体来说,CXCR5+亚群中基因编码的TNF家族蛋白及其受体,和某些趋化因子受体更加丰富。这表明了两个细胞亚群的不同细胞状态。
此外,研究还发现,当利用T细胞过继转移治疗慢性感染小鼠时,CXCR5+CD8+ T细胞亚群比CXCR5−亚群表现出更好的治疗潜力。此外,联合抗PD-L1疗法还对降低病毒载量产生了协同效应。
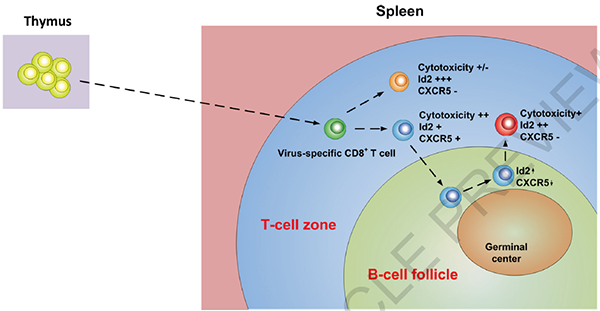
Diagrammatic summary of the fate of CXCR5+ CD8+ T cells during chronic viral infection.(图片来源:Nature)
科学家们还发现,Id2/E2A轴是产生CXCR5+CD8+ T细胞亚群的重要调控因子。研究鉴定出了19种可能与两种细胞亚群基因表达差异相关的转录-结合基序(transcription-binding motifs)。值得注意的是,V$E47_02(一种与转录因子E2A亚型E47相关的结合基序)在CXCR5+亚群中显著富集。
据了解,E2A是转录因子bHLH家族中的一员,根据bHLH结构域的不同,E2A蛋白具有两种形式:E12和E47。与这一结果相一致的是,与CXCR5-亚群相比,CXCR5+细胞亚群表达了更低水平的Id2,它的作用是对抗E2A的转录活性。
研究结论
这一研究证实,在慢性病毒感染期间,Id2/E2A轴驱动病毒特异性CD8 T细胞分化为不同的CXCR5+和CXCR5-亚群。CXCR5-CD8+ T细胞位于T细胞区(T cell zone),受严重原位抑制性微环境的影响,表现出严重的耗竭(exhaustion)。
相比之下,CXCR5+CD8+ T细胞会迁移到B细胞滤泡中。这一区域的抑制性微环境较弱,有效防止了这类细胞效应器功能的快速损失。
不过,随着Id2表达的增加,CXCR5+ CD8+ T细胞最终也会变成CXCR5- CD8+ T细胞。研究证实,这一新转换而成的CXCR5- CD8+ T具有更好的细胞毒性;离开B细胞滤泡后,它们能够更有效的清除病毒感染细胞。
研究还表明,HIV特异性CXCR5+CD8+ T过继转移或者靶向E2A/Id2轴有望更有效地清除HIV感染。此外,考虑到慢性病毒感染和癌症之间很大程度上共享了T细胞耗竭机制,这项研究可能为癌症免疫疗法带来新的曙光。
推荐阅读







