本文转载自“医药观澜”。
6月26日,中国国家药品监督管理局(NMPA)药品审评中心发布公开征求ICH指导原则《E19:安全性数据收集的优化》意见的通知,ICH E19成为近年来药品审评中心发布的第8个ICH指导原则征求意见稿。在参与ICH指南制修订,转化和实施ICH指导原则方面,目前中国药监局正在稳步推进各项工作。

▲ICH指导原则征求意见稿(资料来源:ICH工作办公室)
时钟拨回至2017年北京时间6月19日16时,中国NMPA和国际人用药品注册技术协调会(ICH)总部同时发布消息:中国国家食品药品监督管理总局以成员身份加入ICH,成为其全球第8个监管机构成员。
消息一出,中国医药行业为之振奋,此举将加快中国药品监管和研发的国际化进程。ICH是目前国际上药品注册领域最核心国际规则制订机制。自1990年成立以来,经过二十多年的发展,ICH发布的技术指南已经为全球主要国家药品监管机构接受和转化。
当时钟快速转至下一个年轮,在2018年6月7日12点30分,NMPA宣布,中国国家药品监督管理局当选为ICH管理委员会成员。ICH管委会是ICH的管理和决策机构,加入管委会意味着NMPA得到ICH管委会和ICH全体大会的确认,同时,中国在国际药品研发和注册技术要求领域有了发言权和参与决策权。
为此,NMPA专门在药品审评中心内成立ICH工作办公室,专门负责药监局ICH工作统筹协调,确保各项工作有序开展。经过2年的发展,ICH指导原则在中国已得到逐步转化和实施。
截至目前,CDE已翻译和发布共计97个与ICH有关的指导原则、问答文件、工作计划等。从数量来看,已完成约65%的中文译稿。其中,质量Q系列有38个,安全性S系列有15个,有效性E系列有29个,多学科M系列有15个。同时,CDE还发布了52个ICH指导原则中文翻译稿的征求意见通知。
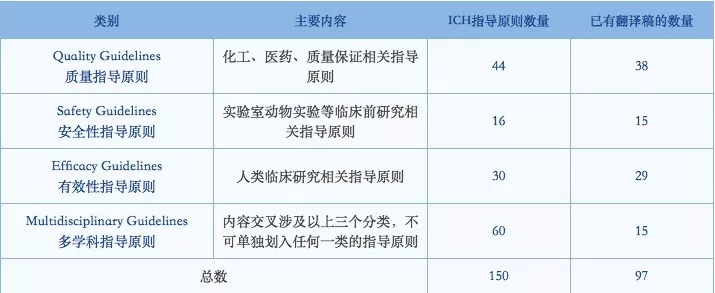
▲ICH指导原则概况(图片来源:ICH工作办公室)
2018年1月,NMPA决定适用《M4:人用药物注册申请通用技术文档(CTD)》《E2A:临床安全数据的管理:快速报告的定义和标准》《E2D:上市后安全数据的管理:快速报告的定义和标准》《M1:监管活动医学词典(MedDRA)》和《E2B(R3):临床安全数据的管理:个例安全报告传输的数据元素》5个ICH二级指导原则。这是NMPA加入ICH后,首次公告适用ICH指导原则。
除了翻译和分阶段实施ICH相关指导原则,CDE还参与了ICH指导原则制修订过程。通常,ICH指导原则制修订过程分为5个阶段:第1阶段构筑共识,第2阶段确认共识和采纳指导原则草案,第3阶段监管机构征求意见和讨论,第4阶段采纳指导原则,第5阶段实施指导原则。
2017年11月,CDE公开征求ICH指导原则《E9(R1):临床试验中的估计目标与敏感性分析》及《S5(R3):人用药物生殖毒性检测》的意见。这也是中国药监局首次参与ICH指导原则制修订过程。
此后,CDE先后在2018年发布了《Q12:产品生命周期管理的技术和法规考虑》、《Q3D(R1):元素杂质指导原则》、《M9:基于生物药剂学分类系统的生物等效性豁免》、《S11:支持儿科用药开发的非临床安全性评价》等4项指导原则的征求意见稿。
进入2019年以来,CDE更是加快ICH的中国进程。共计发布了7个指导原则中文翻译稿的征求意见通知,以及《M10:生物样品分析方法验证》、《E19:安全性数据收集的优化》等2个征求意见稿。

▲ICH指导原则中文翻译稿(资料来源:ICH工作办公室)
根据ICH办公室公告,截至目前,ICH指导原则中仍有53个指导原则尚未有中文翻译稿,其中45个为多学科指导原则,6个为质量指导原则。而安全性S和有效性E方面的中文译稿均已基本完成。
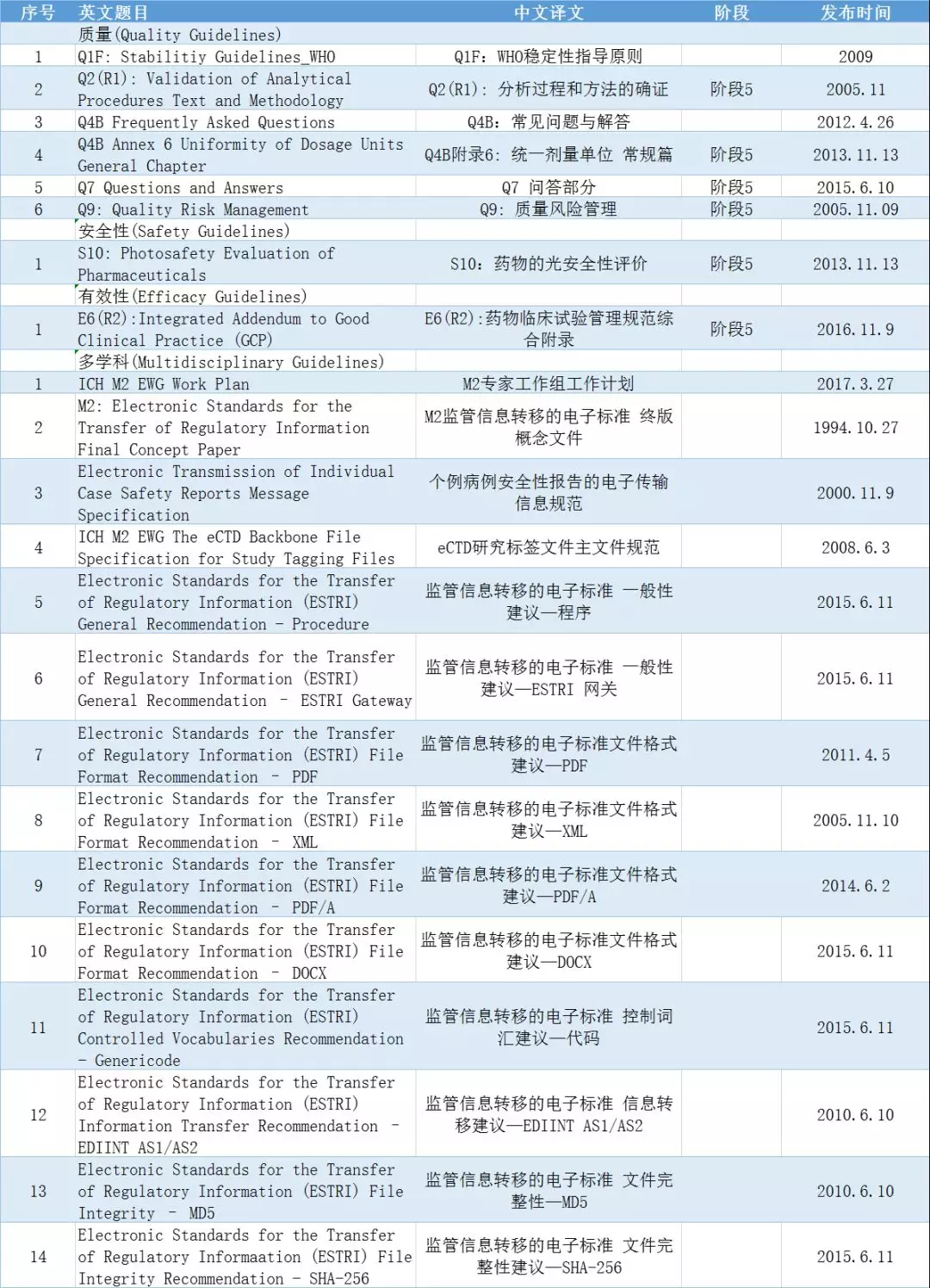
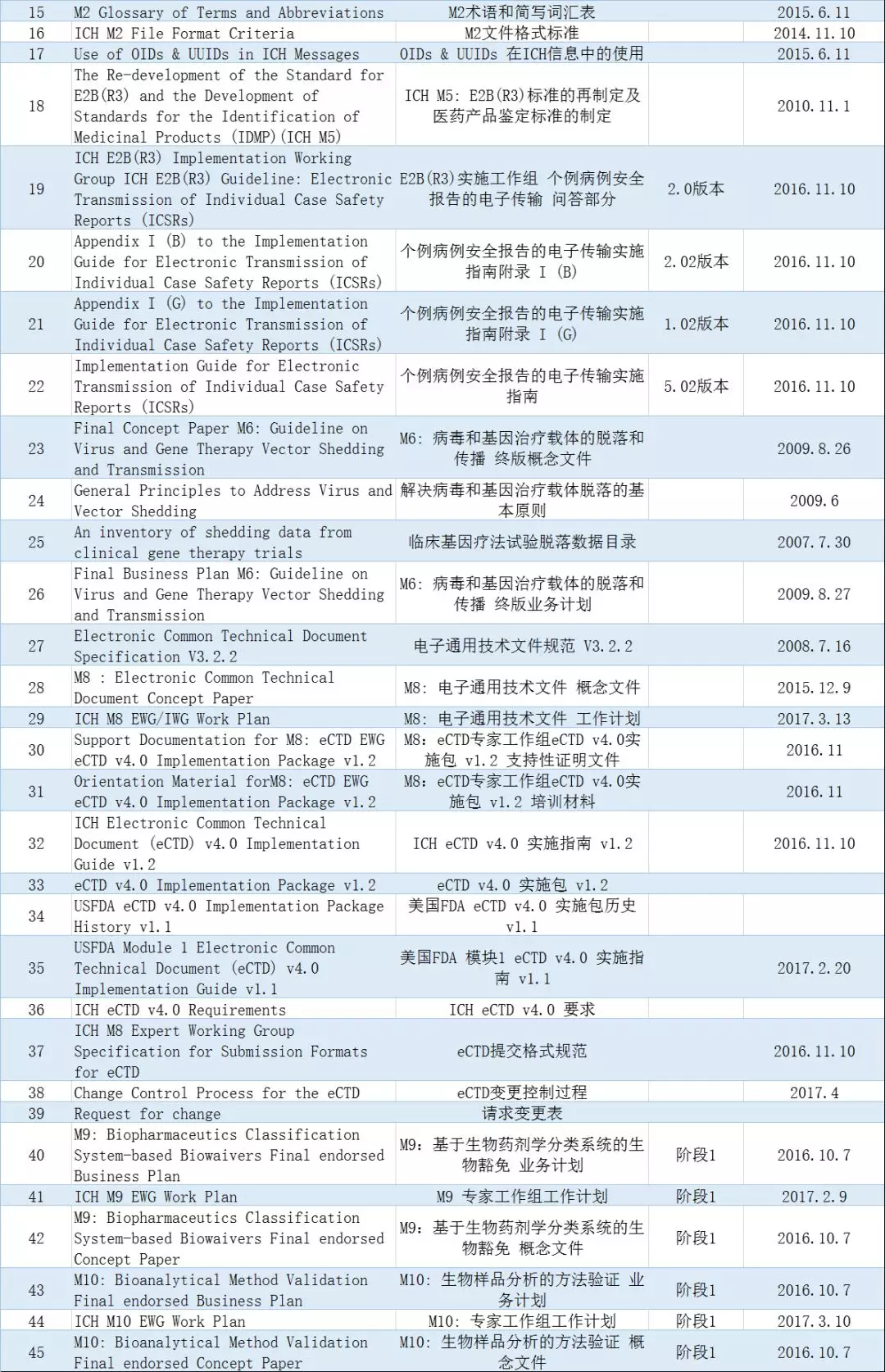
▲ICH指导原则尚无中文译稿列表(资料来源:ICH工作办公室)
加入ICH,一方面能让中国的药品监管能力和水平逐步国际化,全面提升中国制药企业的创新能力。另一方面,能够鼓励国际创新型制药企业将中国市场纳入其全球药物开发战略,推动国际创新药品进入中国。ICH相关工作的稳步推进,将进一步满足临床用药需求,为患者带来更多的治疗选择。







