本文转自医药魔方数据微信,发布已获医药魔方授权,如需转载,请与医药魔方联系。
随着一系列治愈性口服丙肝新药的上市,全球丙肝药市场在近3年经历了一个“迅猛爆发、快速饱和、急剧萎缩”的过程。中国目前的丙肝患病率大约在1%左右,是一个看得见的大市场。当欧美日等规范市场饱和之后,药企的目光自然就聚焦在了中国。
尽管目前尚未有任何一个口服直接抗病毒药物(DAAs)在国内上市,但是随着这类药物在医患群体中的知晓度不断提高,一大波制药企业扎堆申报,CDE优先审评持续推进,特别是BMS、强生、歌礼等一系列DAAs在近期陆续报产,中国丙肝药市场大变局的号声已经吹响。中国丙肝药市场无疑是庞大的,但数量如此多的内资外资药企进行混战,竞争无疑也是极其残酷的。在谈谁能胜出之前,我们有必要对这个市场有更清晰的认知。
干扰素疗法:夕阳无限好,只是近黄昏
在索非布韦面世之前,全球的丙肝标准治疗方案是“干扰素注射+利巴韦林+DAA”,罗氏Pegasys(聚乙二醇干扰素α-2a,派罗欣)、默沙东PegIntron(聚乙二醇干扰素α-2b,佩乐能)等产品也都曾盛极一时,但治愈性全口服DAAs药物在海外的陆续上市让其销售额急剧跳水,PegIntron的销售数据甚至已经不在默沙东的财报中体现,距离退市似乎已经不远。中国已经成为长效干扰素制剂业绩的最后一个支撑点。
长效干扰素α-2药物的全球市场表现
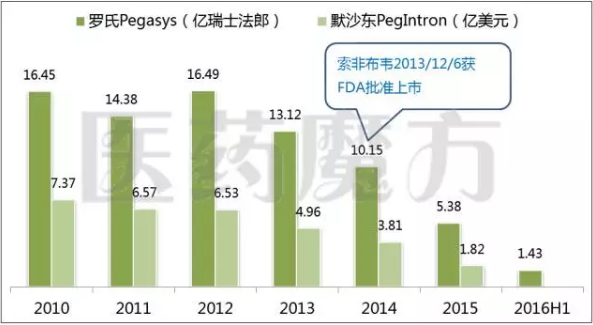
来源:公司财报、医药魔方
就当前国内丙肝市场用药而言,因为DAAs药物尚未上市,干扰素目前仍是主流用药。市场上的主要玩家包括罗氏派罗欣(长效)、默沙东佩乐能(长效)、凯因科技的凯因益生(重组人干扰素α2b,短效)、华立达生物安福隆(重组人干扰素α2b,短效)、安科生物安达芬(干扰素α-2b,短效)等。从市场份额上看,长效干扰素遥遥领先,在国内市场合计占到近80%的份额,远超国内企业的短效干扰素产品。
国内主要干扰素产品的市场份额
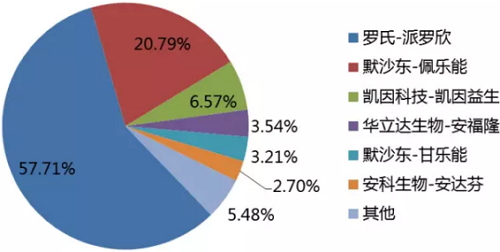
来源:IMS Health
厦门特宝生物的长效干扰素产品派格宾(聚乙二醇干扰素α-2b)已经于2016/9/2获批治疗丙肝,将凭借价格优势搅动长效干扰素制剂在国内丙肝市场的统治地位,而且派格宾的乙肝适应症预计会在2017年获批,将进一步对长效干扰素造成冲击。
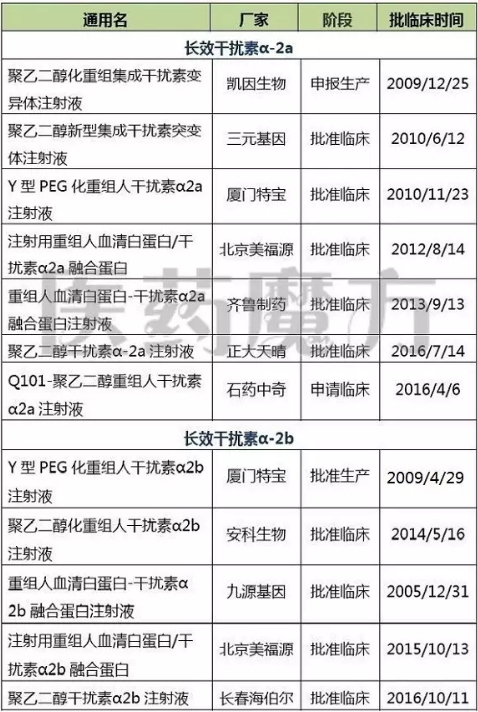
此外,根据凯因生物2016/6/18招股说明书的信息,聚乙二醇化重组集成干扰素变异体注射液已经报产。不过目前从CDE网站尚未查到相关信息,猜测受理号仍停留在省局。除了厦门特宝生物和凯因生物之外,还有一大波国内企业的长效干扰素产品已经获批临床,未来将与罗氏、默沙东竞争国内市场。
国内企业长效干扰素产品注册申报情况
口服DAAs:国内药企在仰望,Gilead在月亮之上
从Sovaldi到Harvoni,再到治疗全基因型丙肝的Epclusa,Gilead可谓是吊足了国内丙肝患者和医生的胃口,但是Gilead的神药就像挂在月亮之上一样遥不可及。Gilead授权20家公司仿制Sovaldi,允许销往100多个发展中国家,让其售价降至10美元/片,但这些福利均与中国无缘,反而间接催热了国内的医疗旅游行业……
所以问题来了,谁会是国内第一个上市的口服DAAs?索非布韦什么时候上市?相信这是大家都比较关注的问题。
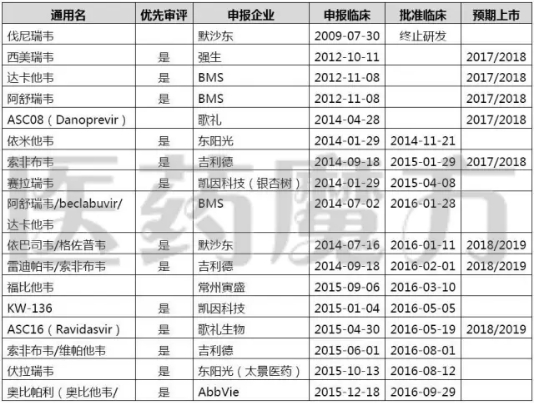
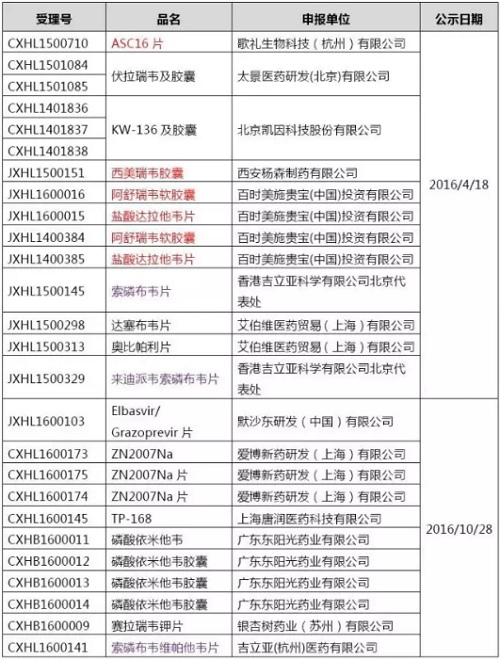
截至目前,在国内申报生产的口服DAAs品种共有4个,分别是BMS的阿舒瑞韦(Asunaprevir)、达卡他韦(Daclatasvir),强生的西美瑞韦(Simeprevir)。歌礼生物12月27日宣布ASC08(Danoprevir)已经申报生产并获CFDA受理,成为第一家报产DAAs的本土药企,不过在CDE官网上还查不到该申请对应的受理号。
已报产的口服DAAs

从开发进度上看,BMS、强生率先报产并不意外,因为其临床申请早在4月18日就获得了CDE优先审评,同意免临床后再报产,CDE的工作效率还是很高的。歌礼生物虽然获得优先审评的是ASC16(Ravidasvir),但由于ASC08比ASC16提前1年申报临床,领先ASC16报产也属正常进度。
公示获得优先审评的丙肝药物
令大家疑惑的地方可能在于,Gilead的三大明星药Sovaldi(索磷布韦片)、Harvoni(来迪派韦/索磷布韦片)和Epclusa(索磷布韦韦帕他韦片)明明与BMS、强生同时获得优先审评,最早在国内申报的索非布韦怎么就迟迟不见报产呢?我们在此帮大家推测一下Gilead内心的小算盘:
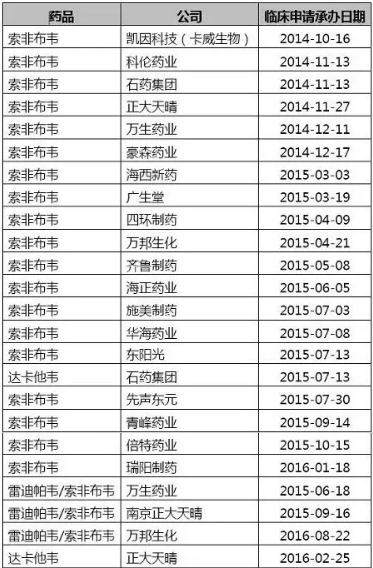
国内目前有22家企业在开发索非布韦,如果Gilead的原研药不获批上市,国内企业就需要按照3.1类申报要求开展验证性临床试验。如果Gilead的索非布韦报产并获批,国内企业就可以按照6类仿制药的要求直接开展BE,快速跟进。
Harvoni(来迪派韦/索磷布韦)的治疗效果、覆盖人群均优于Sovaldi,Gilead放弃报产Sovaldi,直接报产Harvonil也不是没有可能,毕竟Harvoni也是在4月18日也获得过优先审评的。所以Gilead迟迟不报产索非布韦很可能是对国内企业的一个战略性卡位。
有人会说索非布韦不是2024年才专利期保护到期吗?这个问题真的不好讲,强仿也不是没有可能。
DAAs申报临床的国内企业
中国丙肝市场的机会在哪?
前文提到中国市场是一个大家都能看得到的丙肝大市场,但不同统计口径下的中国丙肝患者数量并不相同,若按患病率1%计算,中国丙肝患者也超过1300万,患者池是美国的3倍以上,想象空间无限。
但制药企业在中国丙肝市场会面临两个主要问题:
中国医保支付能力有限,84000美元(12周一个疗程,合人民币56万元)治愈1例丙肝患者显然是不可能承受的,如何兼顾盈利和可及性是非常考验药企智慧的一件事情。
中国丙肝治疗率很低。行业人士依据国内销售收入及市场份额的推算结果显示,国内每年能用得起长效干扰素的具有支付能力的丙肝患者仅2.5万人左右。这个数字也是未来支付得起DAAs新药的患者人数,是不是相比1300万显得非常骨感?
对治愈性口服DAAs药物来说,要想在国内市场打开局面,以下两个问题是必须解决好的:
定价问题。如果参考印度强仿索非布韦做到10美元/片的价格,拿840美元(5600元)治愈1例患者是最为理想的,但显然也只是空想而已。预期6万-10万元左右治愈1例患者是医保和药企双方都可以接受的,对患者而言,相比现有疗法并没有增加太多治疗成本,对医保来说,治愈丙肝可以减轻后续治疗肝硬化、肝癌等医疗卫生投入。如果按每年2.5万人接受治疗计算的话,国内DAAs市场大约是20亿元的容量,这也与当前干扰素市场的容量基本一致。
提高丙肝患者的诊断率。治疗率的提高一方面取决于医保和患者的支付能力,另一方面则取决于诊断率。如果将每年的治疗人数提高到10万人,那么国内丙肝市场就是100亿元的容量。这样以来,几乎每个开发治愈性口服DAAs的厂家都能分到足够的市场蛋糕。
至于干扰素类药物,虽然面临DDAs的巨大冲击,但某些丙肝患者考虑到疾病分型的原因,或者是治疗成本的原因,还必须选择使用干扰素。如果未来几年将接受治疗丙肝患者的基数扩大3~5倍,相信在国内市场的表现并不会像全球市场那样衰减得如此剧烈。但长远来看,干扰素产品的舞台可能只在乙肝上了。
最后再围观一下丙肝创新药在国内的注册审批情况吧,2017年DAAs必定是要上市了,至于谁能抢到头筹,需要考量的因素就太多了,只能说笑到最后的才算赢。
丙肝新药在国内的注册进度一览