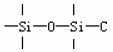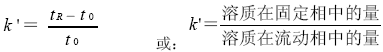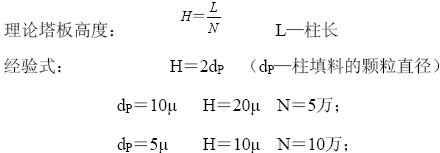高效液相色谱(HPLC:High Performance Liquid Chromatography)是化学、生物化学与分子生物学、医药学、农业、环保、商检、药检、法检等学科领域与专业最为重要的分离分析技术,是分析化学家、生物化学家等用以解决他们面临的各种实际分离分析课题必不可缺少的工具。
高效液相色谱的优点是:检测的分辨率和灵敏度高,分析速度快,重复性好,定量精度高,应用范围广。适用于分析高沸点、大分子、强极性、热稳定性差的化合物。其缺点是:价格昂贵,要用各种填料柱,容量小,分析生物大分子和无机离子困难,流动相消耗大且有毒性的居多。目前的发展趋
势是向生物化学和药物分析及制备型倾斜。
基本原理
HPLC 是利用样品中的溶质在固定相和流动相之间分配系数的不同,进行连续的无数次的交换和分配而达到分离的过程,如图2-27。
按照分离机制不同,高效液相色谱可分为:
高效分配色谱(分配系数 ),高效亲和色谱(亲和力),高效吸附色谱(吸附力),高效离子交换色谱(离子交换能力),高效凝胶色谱(分子大小而引起的体积排阻色谱)。
高效分配色谱又可分为:
正相色谱:固定相为极性,流动相为非极性。
反相色谱:固定相为非极性,流动相为极性 (用的最多,约占60~70%)。
(1)固定相(柱填料)
固定相分为两类,一类是使用最多的微粒硅胶,另一类是使用较少的高分子微球。后者的优点是强度大、化学惰性,使用pH 范围大,pH=1~14,缺点是柱效较小,常用于离子交换色谱和凝胶色谱。
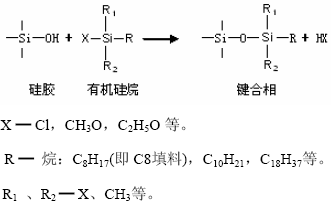
最常使用的全孔微粒硅胶 (3~10μm)是化学键合固定相硅胶,这种固定相要占所有柱填料的80%。它是通过化学反应把某种适当的化学官能团(例如各种有机硅烷),键合到硅胶表面上,取代了羟基(-OH)而成。它是近代高效液相色谱技术中最重要的柱填料类型。
使用微粒硅胶要特别注意它的使用pH 范围是 2~7.5,若过碱(>pH7.5),硅胶会粉碎或溶解;若过酸(< pH2=键合相的化学键会断裂。
键合相使用硅胶作基质的优点是:硅胶的强度大;微粒硅胶的孔结构和表面积易人为控制。化学稳定性好。重要的键合相是:硅烷化键合相,它是硅胶与有机硅烷反应的产物。
图 2—28 最常用的硅烷化键合相键型
最常用的”万能柱”填料为”C18”,简称”ODS”柱,即十八烷基硅烷键合硅胶填料(Octadecylsilyl,简称ODS)。这种填料在反相色谱中发挥着极为重要的作用,它可完成高效液相色谱70~80%的分析任务。由于C18(ODS)是长链烷基键合相,有较高的碳含量和更好的疏水性,对各种类型的生物大分子有更强的适应能力,因此在生物化学分析工作中应用的最为广泛,近年来,为适应氨基酸、小肽等生物分子的分析任务,又发展了CH、C3、C4等短链烷基键合相和大孔硅胶(20~40μm)。
按键合到基质上的官能团可分为:
反相柱:填料是非极性的,官能团为烷烃,例如:C18(ODS)、C8、C4等。
正相柱:填料是极性的,官能团为 -CN 氰基、-NH2氨基等。
离子交换键合相:
阳离子官能团:-SO3H 磺酸基、-COOH 羧基等。
阴离子官能团:―R4N+季铵基、-NH2氨基等。
( 由于硅胶基质的键合相只能在pH=2~7.5的范围内使用,而离子交换色谱要求有更宽的pH范围,因此其基质现在仍主要使用聚苯乙烯和二乙烯苯。)
(2) 流动相:
反相色谱最常用的流动相及其冲洗强度如下:
H2O<甲醇<乙腈<乙醇<丙醇<异丙醇<四氢呋喃
最常用的流动相组成是:”甲醇-H2O”和”乙腈-H2O”,由于乙腈的剧毒性,通常优先考虑”甲醇-H2O” 流动相。
反相色谱中,溶质按其疏水性大小进行分离,极性越大疏水性越小的溶质,越不易与非极性的固定相结合,所以先被洗脱下来。流动相的pH 对样品溶质的电离状态影响很大,进而影响其疏水性,所以在分离肽类和蛋白质等生物大分子的过程中,经常要加入修饰性的离子对物质,最常用的离子对试剂是三氟乙酸(TFA),使用浓度为0.1%,使流动相的pH 值为2~3,这样可以有效地抑制氨基酸上α羧基的离,使其疏水性增加,延长洗脱时间,提高分辨率和分离效果。
完全离子化的溶质,例如强酸或强碱,其在反相键合相上的保留值很低,近于死时间流出,不能进行分析。根据离子对色谱的原理将一种与样品离子电荷(A+)相反的离子(B-),称为对离子,加入到流动相中,使其与样品离子结合生成弱极性的离子对,即中性缔合物,从而增强了样品的疏水性,加大了保留值,改善了分离效果。
正相色谱常用的流动相及其冲洗强度的顺序是:
正己烷<乙醚<乙酸乙酯<异丙醇
其中最常用的是正已烷,虽然其价格较贵,但80%的顺、反和邻位、对位异构体仍然要用正相色谱来进行分离。
流动相的选择原则是:①样品易溶,且溶解度尽可能大。②化学性质稳定,不损坏柱子。③不妨碍检测器检测,紫外波长处无吸收。④粘度低,流动性好。⑤易于从其中回收样品。⑥无毒或低毒,易于操作。⑦易于制成高纯度,即色谱纯。⑧废液易处理,不污染环境。
基本参数
(1)保留值
图2—29 保留值示意图
①保留时间”tR”:进样至出峰的时间。
②死时间”t0”:不被柱子吸附的惰性物质的出峰时间。死时间”t0”的测定通常是使用不被柱子保留而又有紫外吸收的惰性物质,例如:正相色谱常用四氯化碳,反相色谱常用甲醇、尿嘧啶、NaNO2、NaNO3等。
③ 容量因子”k´”:
“k´”是比”tR”还常用的保留值,它与柱子的大小及流速无关,只与溶质在固定相和流动相的分配性质、柱温以及相空间比(即固定相和流动相之体积比)有关。
”k´”又定义为在分配平衡时某溶质在两相中绝对量之比,消除了保留值的波动因素,而平衡常数”K”是平衡时物质在两相中的浓度比。
k´ 值的范围: 0.4<k´<20~30 k´=2~5为佳,过大则耗时太长。
④保留体积: VR=tR•FC
FC 是流动相的流速 mL/min;
VR 是在tR 时间内流动相流过柱子的体积。
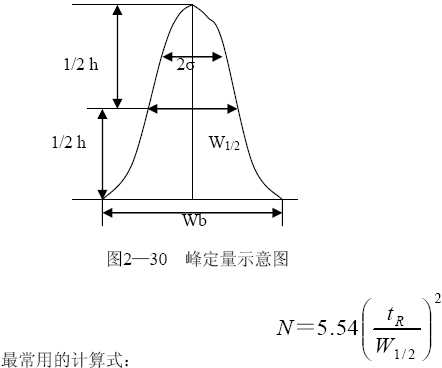
柱效的测定和计算:
以反相柱为例,流动相用87%(V/V)的甲醇:水,样品用苯、联苯、萘等,加快记录仪的走纸速度,
测出半峰宽W1/2,并由走纸速度换算为与tR 相同的单位”分”或”秒”,代入公式,计算出柱效N。