层析技术是近代生物化学实验中常用的分析方法。任何层析过程都是在两个相中进行的。一是固定于支持物上的固定相,另一是流经固定相的流动相,由于样品中各组分理化性质(如溶解度、吸附能力、分子形状、分子所带电荷的性质和数量、分子表面的特殊基团、分子量等)不同,表现出对固定相和流动相的亲和力也各不相同。当混杂物通过多孔的支持物时,它们受固定相的阻力和受流动相的推力也不同,各组分移动速度各异并在支持物上集中分布于不同的区域,从而使各组分得以分离。
根据层析法中两相的性质和操作方法的不同可分为许多类型。本章介绍几种常用的层析方法。
一、吸附层析 (Absorption>Chromatography>)
吸附作用是指某些物质能够从溶液中将溶质浓集在其表面的现象。吸附剂吸附能力的强弱与被吸附物质的化学结构、溶剂的本质和吸附剂的本质有关。当改变吸附剂周围溶剂成分时,吸附剂对被吸附物质的亲和力便发生变化,使被吸附物质从吸附剂上解脱下来,这一解脱过程称为“洗脱”或“展层”。
吸附层析是把吸附剂装入玻璃柱内(柱层析法)或铺在玻璃板上(薄层层析法)。由于吸附剂的吸附能力可受溶剂影响而发生改变,样品中的物质被吸附剂吸附后,用适当的洗脱液冲洗,改变吸附剂的吸附能力,使之解吸,随洗脱液向前移动。当解吸下来的物质向前移动时,遇到前面新的吸附剂又重新被吸附。此被吸附的物质再被后来的洗脱液解脱下来。经如此反复的吸附—解吸—再吸附—再解吸的过程,物质即可沿着洗脱液的前进方向移动。其移动速度取决于吸附剂对该物质的吸附能力。由于同一吸附剂对样品中各组分的吸附能力不同,所以在洗脱过程中各组分便会由于移动速度不同而逐渐分离出来,这就是吸附层析的基本过程。
实验中常用的固体吸附剂有氧化铝、硅酸镁、磷酸钙、氢氧化钙、活性钙、蔗糖、纤维素和淀粉。常用的洗脱液有乙烷、苯乙醚、氯仿,以及乙醇、丙酮或水与有机溶剂形成的各种混合物。吸附层析通常用于分离脂类、类固醇类、类胡罗卜素、叶绿素以及它们的前体等非极性和极性不强的有机物。
值得提出的是,几乎所有的溶质对于所有的层析介质,即使是惰性的物质都有一定限度的吸附力,除吸附层析本身之外,吸附作用还或多或少地存在于所有其他类型的层析中。
二、分配层析(Partition>Chromatography)
分配层析是利用混合物中各组分在两相中分配系数不同而达到分离目的的层析技术,相当于一种连续性的溶剂抽提方法。
在分配层析中,固定相是极性溶剂(例如水、稀硫酸、甲醇等)。此类溶剂能和多孔的支持物(常用的是吸附力小、反应性弱的惰性物质如淀粉、纤维素粉,滤纸等)紧密结合,使呈不流动状态;流动相则是非极性的有机溶剂。分配系数(a)是指在一定温度
和压力条件下物质在固定相和流动相两部分浓度达到平衡时的浓度比值。
|
分配系数(a)= |
物质在固定相中的浓度 |
|
物质在流动相中的浓度 |
在层析过程中,当有机溶剂流动相流经样品点时,样品中的溶质便按其分配系数部分地转入流动相向前移动。当经过前方固定相时,流动相中的溶质就会进行分配,一部分进入固定相。通过这样不断进行的流动和再分配,溶质沿着流动方向不断前进。各种溶质由于分配系数不同,向前移动的速度也各不相同。分配系数较大的物质,由于分配在固定相多些,分配在流动相少些,溶质移动较慢;而分配系数较小的物质,移动速度较快。从而将分配系数不同的物质分离开来。
支持物在分配层析中起支持固定相的作用,根据其使用方式也分柱层析和薄层层析两种。
用滤纸做支持物的纸层析法是最常用的分配层析。实验中应选用厚度适当、质地均一、含金属离子(钙、铜、镁、铁等)尽量少的滤纸为支持物。
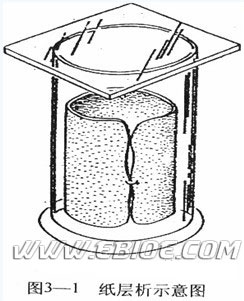
滤纸中吸附着的水(约含20-22%)是常用的固定相。酚、醇是常用的流动相。展层方法多可采用垂直型(图3-1),也可采用水平型。把欲分离的样品点加于纸的一端,使流动相经此移动,这样在两相间就发生分配现象。
根据样品中各组中的分配系数不同,它们就逐渐集中于纸上不同的部位。
各组分在滤纸上的移动速度可用迁移率(Rf)来表示。
>
|
Rf> = |
溶质层析点中心到原点中心的距离 |
|
溶剂前沿到原点中心的距离 |
在纸层析中,Rf值的大小主要取决于该组分的分配系数。分配系数大者移动速度慢,其Rf值也小;反之分配系数小者移动速度快Rf值也大。因为每种物质在一定条件下对于一定的溶剂系统,其分配系数是一定的,Rf值也恒定。因此可以根据Rf值对分离的物质进行鉴定。
有时几种成分在一个溶剂系统中层析所得Rf值相近,不易分离清楚。这时可以在第一次层析后将滤纸吹干逆转90 o角,再采用另一种溶剂系统进行第二次层析,往往可以得到满意的分离效果。这种方法称为“双向纸层析法”(图3-2)。
三、离子交换层析(Ion-exchange>Chromatography)
离子交换层析是利用离子交换剂对需要分离的各种离子具有不同的亲和力(静电引力)而达到分离目的的层析技术。离子交换层析的固定相是离子交换剂,流动相是具有一定pH和一定离子强度的电解质溶液。
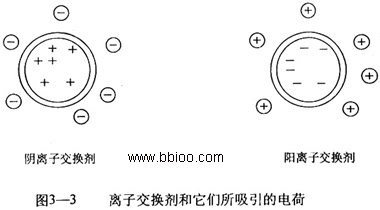
离子交换剂是具有酸性或碱性基团的不溶性高分子化合物,这些带电荷的酸性或碱性基团与其母体以共价键相连,这些基团所吸引的阳离子或阴离子可以与水溶液中的阳离子或阴离子进行可逆的交换。因此根据可交换离子的性质将离子交换剂分为两大类:阳离子交换剂和阴离子交换剂(图3-3)。
据离子交换剂的化学性质,可将其分为离子交换树脂、离子交换纤维素和离子交换葡聚糖等多种。
离子交换树脂是人工合成的高分子化合物,生化实验中所用的离子交换树脂多为交联聚苯乙稀衍生物。离子交换树脂多用于样品去离子,从废液中回收所需的离子和水的处理等。由于它可使不稳定的生物大分子变性,因此不适用于对生物样品进行分离。
离子交换纤维素(图3-4)可用于生物大分子的分离。其缺点是分子形态不规则,孔隙不均一,对要求非常严格的试验尚不够满意。

图4-3 DEAE-纤维素部分结构
>>>>>>> 较为理想的离子交换剂是离子交换葡聚糖凝胶和离子交换琼脂糖凝胶。它们具有颗粒整齐,孔径均一等优点,往往得到较好的分离效果。
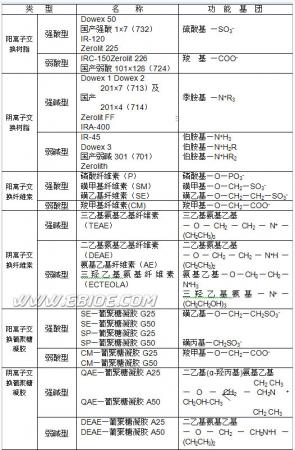
根据各种离子交换剂所带酸性和碱性功能团的不同和其解离能力的差异,各种交换剂又可进一步分为强酸型、弱酸型、强碱型和弱碱型四种,现列于表3-1。
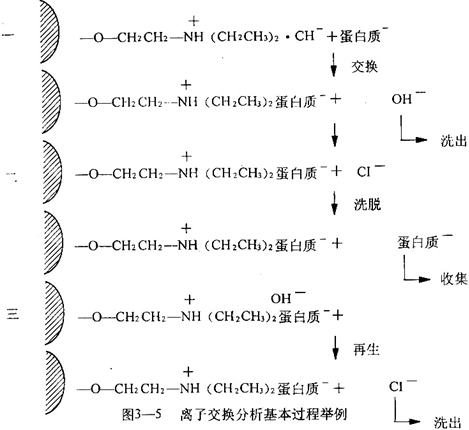
离子交换层析的基本过程是:离子交换剂经适当处理装柱后,应该先用酸或碱处理(视具体情况可用一定pH的缓冲液处理),使离子交换剂变成相应的离子型(阳离子交换剂带负电并吸引相反离子H+,阴离子交换剂带正电并吸引相反离子OH-,加入样品后,使样品与交换剂所吸引的相反离子(H+或OH-)进行交换,样品中待分离物质便通过共价键吸附于离子交换剂上(图 3-5),然后用基本上不会改变交换剂对样品离子亲和状态的溶液(如起始缓冲液)充分冲洗,使未吸附的物质洗出。洗脱待分离物质常用
表 3-1>>>>离子交换剂的类型及其功能基团
两种方法,一是制作电解质浓度梯度,即离子强度梯度。通过不断增加离子强度,吸附到交换剂上的物质根据其静电引力的大小而不断竞争性的洗脱下来;二是制作pH梯度,影响样品电离能力,也使交换剂与样品离子亲和力下降,当pH梯度接近各样品离子的等电点时,该离子就被洗脱下来。在实际工作中,离子强度梯度和pH梯度可以是连续的(称连续梯度洗脱),也可以是不连续的(称阶段洗脱)。
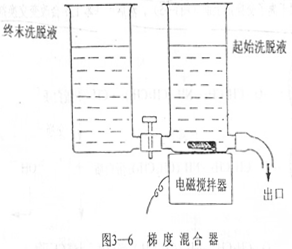
一般来讲,前者分离的效果比后者的分离效果理想,梯度洗脱需要梯度混合器来制造离子强度梯度或pH梯度。
图3-6为最简单的一种梯度混合器,它由两个容器组成,两容器之间以连通管相连接,与出口连接的容器装有搅拌装置,内盛起始洗脱液,此洗脱液代表开始洗脱的离子强度(或起始pH);另一容器内盛有终末洗脱液,此洗脱液代表洗脱的最后离子强度(或最后pH)。在洗脱过程中,由于终末洗脱液不断进入起始洗脱液中,并不断被搅拌均匀,所以流出的洗脱液成分不断的由起始状态向终末状态演变形成连续的梯度变化。