一、目的:
(1)初步掌握利用凝胶层析法测定蛋白质分子量的原理。
(2)学习用标准蛋白质混合液制作Ve,Kav对1gMr的“选择曲线”以及测定未知蛋白质样品分子量的方法。
二、原理:
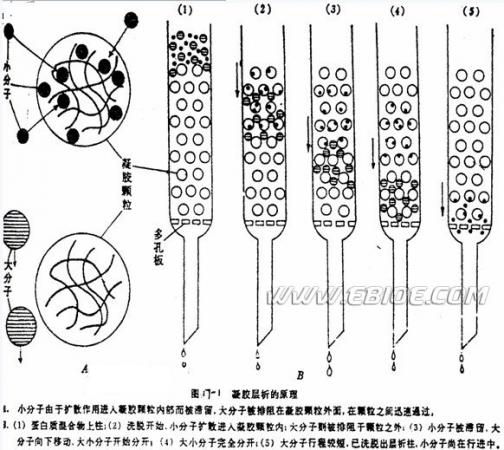
凝胶层析法(即凝胶过滤法,gel filtration)是利用凝胶把分子大小不同的物质分离开的一种方法,又叫做分子筛层析法(molecular sieve chromatography),排阻层析法(exclusion chromatography)。凝胶本身是一种分子筛,它可以把分子按大小不同进行分离,好象过筛可以把大颗粒与小颗粒分开一样。但这种“过筛”与普通的过筛不一样。将凝胶颗粒在适宜溶剂中浸泡,使充分吸液膨胀,然后装入层析柱中,加入欲分离的混合物后,再以同一溶剂洗脱,在洗脱过程中,大分子不能进入凝胶内部而沿凝胶颗粒间的空隙最先流出柱外,而小分子可以进入凝胶内部,流速缓慢,以致最后流出柱外,从而使样品中分子大小不同的物质得到分离。分离过程中的示意见图17-1。
凝胶是由胶体溶液凝结而成的固体物质,不论是天然凝胶还是人工合成凝胶,它们的内部都具有很微细的多孔网状结构。凝胶层析法常用的天然凝胶是琼脂糖凝胶(agarose gel,商品名Sepharose),人工合成凝胶是聚丙烯酰胺凝胶(商品名为Bio-gel-P)和葡聚糖(dextran)凝胶,后者的商品名称为Sephadex型的各种交联葡聚糖凝胶,它是个有不同孔隙度的立体网状结构的凝胶,不溶于水,其化学结构式如图17-2所示。
这种聚合物的立体网状结构,其孔隙大小与被分离物质分子的大小有相应的数量级。在凝胶充分溶胀后,交联度高的,孔隙小,只有相应的小分子可以通过,适于分离小分子物质。相反,交联度低的孔隙大,适于分离大分子物质。利用这种性质可分离不同分子量的物质。
为了说明凝胶层析的原理,将凝胶装柱后,柱床体积称为“总体积”,以Vt(total volume)表示。实际上Vt是由Vo,Vi与Vg三部分组成,即:
Vt=Vo+Vi+Vg
Vo称为“孔隙体积”或“外体积”(outer volume)又称“外水体积”,即存在于柱床内凝胶颗粒外面空隙之间的水相体积,相应于一般层析法中柱内流动相的体积;Vi为内体
积(inner volume),又称“内水体积”,即凝胶颗粒内部所含水相的体积,相应于一般层析法中的固定相的体积,它可从干凝胶颗粒重量和吸水后的重量求得;Vg为凝胶本身的体积,因此Vt—Vo等于Vi+Vg 。它们之间的关系可用图17-3表示。


洗脱体积(Ve,elution>Volume)与Vo及Vi之间的关系可用下式表示:
>>>>>>>>>>>>>>Ve=Vo+KdVi
式中Ve为洗脱体积,自加入样品时算起,到组分最大浓度(峰)出现时所流出的体积;Kd为样品组分在二相间的分配系数,也可以说Kd是分子量不同的溶质在凝胶内部和外部的分配系数。
它只与被分离物质分子的大小和凝胶颗粒孔隙的大小分布有关,而与柱的长短粗细无关,也就是说它对每一物质为常数,与柱的物理条件无关。Kd可通过实验求得,上式可改写成:
上式中Ve为实际测得的洗脱体积;Vo可用不被凝胶滞留的大分子物质的溶液(最好有颜色以便于观察,如血红蛋白,印度黑墨水,分子量约200万的蓝色葡聚糖-2000等)通过实际测量求出;Vi可由g·WR求得(g为干凝胶重,单位为克;WR为凝胶的“吸水量”,以毫升/克表示)。因此,对一层析柱凝胶床来说,只要通过实验得知某一物质的洗脱体积Ve,就可算出它的Kd值。以上关系可用图17-4表示。

Kd可以有下列几种情况:
有颜色以便于观察,如血红蛋白,印度黑墨水,分子量约200万的蓝色葡聚糖-2000等)通过实际测量求出;Vi可由g·WR求得(g为干凝胶重,单位为克;WR为凝胶的“吸水量”,以毫升/克表示)。因此,对一层析柱凝胶床来说,只要通过实验得知某一物质的洗脱体积Ve,就可算出它的Kd值。以上关系可用图17-4表示。
Kd可以有下列几种情况:
1、当Kd=0时,则Ve=Vo。即对于根本不能进入凝胶内部的大分子物质(全排阻),洗脱体积等于空隙体积(图中组分Ⅰ)。
2、当Kd=1时,Ve=Vo+Vi。即小分子可完全渗入凝胶内部时,洗脱体积应为空隙体积与内体积之和(图中组分Ⅲ)。
可以看出,对某一凝胶介质,两种全排出的分子即Kd都等于零,虽然分子大小有差别,但不能有分离效果。同样两种分子如都能进入内部空隙,即Kd都等于1,它们既使分子大小有不同,也没有分离效果。因此不同型号的凝胶介质,有它一定的使用范围。
3、当0<Kd<1时,Ve=Vo+KdVi。表示内体积只有一部分可被组分利用,扩散渗入,Ve即在Vo+Vi之间变化(图中组分Ⅱ)。
4、有时Kd>1,表示凝胶对组分有吸附作用,此时Ve>Vo+Vi。例如一些芳香族化合物的洗脱体积远超出理论计算的最大值,这些化合物的Kd>1。如苯丙氨酸,酪氨酸和色氨酸在Sephadex>G-25中的Kd值分别为1.2,1.4和2.2。
在实际工作中,对小分子物质也得不到Kd=1的数值,特别是交联度大的凝胶差别更大,如用G-10型得Kd 值0.75左右,用G-25型得0.8左右。这是由于一部分水相与凝胶结合较牢固,成为凝胶本身的一部分,因而不起作用,小分子不能扩散入内所致。此时 Vi即不能以g·WR计算,为此也常有直接用小分子物质D2O,NaCl等通过凝胶柱而由实验计算出Vi值的。另一个解决的办法是不使用Vi与Kd,而用Kav(有效分配系数)代替Kd,其定义如下:
已知

在这里实际上将原来以水作为固定相(Vi)改为水与凝胶颗粒(Vi—Vo)作为固定相,而洗脱剂(Ve—Vo)作为流动相。Kav与Kd对交联度小的凝胶差别较小,而对交联度大的凝胶差别大。
在一般情况下,凝胶对组分没有吸附作用时,当流动相流过Vt体积后,所有的组分都应该被洗出来,这一点为凝胶层析法的特点,与一般层析方法不同。
Ve与分子量的关系:对同一类型的化合物,洗脱特性与组分的分子量有关,流过凝胶柱时,按分子量大小顺序流出,分子量大的走在前面。Ve与分子量的关系可用下式表示:
>>>>>>>>>>>V e=K1—K2logMr
K1与K2为常数,Mr为分子量,Ve也可用Ve—Vo(分离体积),Ve/Vo(相对保留体积),Ve/Vt(简化的洗脱体积,它受柱的填充情况的影响较小)或Kav代替,与分子量的关系同上式,只是常数不同。通常多以Kav对分子量的对数作图得一曲线,称为“选择曲线”,如图17-5所示。曲线的斜率是说明凝胶性质的一个很重要的特征。在允许的工作范围内,曲线愈陡,则分级愈好,而工作范围愈窄。凝胶层析主要决定于溶质分子的大小,每一类型的化合物如球蛋白类,右旋糖酐类等都有它自己的特殊的选择曲线,可用以测定未知物的分子量,测定时以使用曲线的直线部分为宜。

用凝胶层析法测定蛋白质的分子量,方法简单,技术易掌握,样品用量少,而且有时不需要纯物质,用一粗制品即可。例如在一粗酶制剂中,为了测定某一酶组分的分子量,只要测定洗脱液中具有该酶最大活性的部分,然后确定其洗脱体积,即可从标准曲线中查出其分子量。
凝胶层析法测定分子量也有一定的局限性,在pH6—8的范围内,线性关系比较好,但在极端pH时,一般蛋白质有可能因变性而偏离。糖蛋白在含糖量超过5%时,测得分子量比真实的要大,铁蛋白则与此相反,测得的分子量比真实的要小。
有一些酶底物是糖,如淀粉酶,溶菌酶等会与葡聚糖凝胶形成络合物,这种络合物与酶-底物络合物相似,因此在葡聚糖凝胶上层析时表现异常。用凝胶层析法所测分子量的结果,要和其它方法的测定相对照,由此才可作出较可靠的结论。
凝胶层析技术操作方便,设备简单,周期短,重复性能好,而且条件温和,一般不引起生物活性物质的变化,目前已得到相当广泛的应用,例如可用于脱盐,浓缩高分子物质的溶液,生化物质的分离提纯,去除热源物质以及用于测定高分子物质的分子量。下面实验是用葡聚糖凝胶层析法测定蛋白质的分子量。

>







