安世民, 曾桥, 滕祥云, 龙志高, 李娟, 潘乾, 邬玲仟, 梁德生, 夏昆, 夏家辉, 张灼华
中南大学医学遗传学国家重点实验室, 长沙410078
摘要: 通过人胚胎干细胞(Human embryonic stem cells, hESCs)经体内分化获取间充质干细胞(Mesenchymal stem cells, MSCs)为人胚胎干细胞提供一种新的滋养层。将约5×106 个hESCs 注射入重症免疫联合缺陷小鼠形成畸胎瘤, 8 周后再从畸胎瘤中分离MSCs 并鉴定, 将MSCs 作为hESCs 的滋养层细胞, 并检测和观察hESCs 的生长情况、细胞特性和分化能力。从畸胎瘤中获得了纯度较高的具有类似骨髓来源的MSC 特性的细胞群, 其形态相似、表面抗原标志相似(CD34 和CD45 阴性, CD29、CD49b、CD105、CD73 和CD90 阳性), 经诱导可以向成骨细胞和成脂细胞分化。将hESCs 在MSCs 滋养层细胞上传代培养10 代以上, hESCs 依然具有正常的细胞形态, 反转录PCR 证实其特异转录因子Oct4、Nanog 的表达, 干细胞表面标记SSEA-1 显示为阴性, SSEA-4、 TRA-1-60、TRA-1-81 显示为阳性, 碱性磷酸酶染色显示为阳性, 并且核型正常。体外EB 形成和体内畸胎瘤形成证明了其全能性。因此来源于hESCs 本身的MSCs 可以被用来作为支持胚胎干细胞生长并维持其未分化状态的滋养层细胞。
关键词: 人胚胎干细胞; 间充质干细胞; 滋养
Growing of human embryonic stem cells on feeders derived from themselves
AN Shi-Min, ZENG Qiao, TENG Xiang-Yun, LONG Zhi-Gao, LI Juan, PAN Qian, WU
Ling-Qian, LIANG De-Sheng, XIA Kun, XIA Jia-Hui, ZHANG Zhuo-Hua
Abstract: This study was carried out to determine whether mesenchymal stem cells (MSCs) derived from teratoma of human embryonic stem cells (hESCs) function as feeder cells to support hESCs growth. Approximately 5×106 hESCs were injected into the hind limb muscle of each SCID-beige mouse to form teratoma. After 8 weeks, the MSCs were isolated from the teratoma and cultured in Mesencult medium. Purified MSCs were then used as the feeder cells for hESCs culture. High purity MSCs derived from teratoma were isolated. The cells were morphologically similar to bone marrow MSCs (bMSCs). The teratoma-derived MSCs were negative for CD34 and CD45 but positive for CD29, CD49b, CD105, CD73, and CD90, which resembled those expressed by bMSCs. After passaged on MSCs feeder cells more than 10 passages, hESCs maintained hESC characteristics in morphology. Reverse PCR showed the expression of Oct4 and Nanog. SSEA-1 was negative and SSEA-4, TRA-1-60, and TRA-1-81 were positive. Alkaline phosphatase staining showed positive results. The karyotype remained normal. Moreover, the hECSs cultured on teratoma-derived MSCs formed teratoma in vivo and embryoid body in vitro confirmed their pluripotency. Accordingly, MSCs derived from hESCs by in vivo differentiation can be used as the feeder cells for hESCs culture. Keywords: human embryonic stem cell; mesenchymal stem cell; feeder cells
人胚胎干细胞(Human embryonic stem cells, hESCs)来自于早期的囊胚或桑椹胚, 它具有以下两个最重要的特性; 全能性和自我更新能力。该特性使得其在再生医学和器官移植等领域具有潜在的重大意义。自1998 年美国威斯康星大学的Thomson 教授建立世界上第一株胚胎干细胞系[1]到目前为止, 在NIH 已经注册了70 株胚胎干细胞系(https:// stemcells.nih.gov/)。大多数人胚胎干细胞系是培养在来源于小鼠胚胎成纤维细胞(Mouse embryonic fibroblast cells, MEF)的滋养层细胞上, MEF 细胞通过与hESC 直接接触及分泌多种因子维持人胚胎干细胞未分化状态。这种培养体系中的hESCs 在应用于临床治疗时存在多个障碍, 其中之一是动物源性病原体的交叉污染[2]。因此如何建立一种人源性的培养体系, 避免治疗中动物源性污染有着重大意义。本研究通过将hESCs 进行体内分化得到MSCs 并作为滋养层细胞, 对培养在MSCs 上的hESCs 进行传代观察, 以期研究和建立一种适合于hESCs 的人源化滋养层培养体系。
材料和方法
1.1 材料
1.1.1 胚胎干细胞和实验动物
本实验采用的胚胎干细胞是购自美国NIH 注册的HSF6 胚胎干细胞株, 核型46, XX; 实验小鼠是购自北京维通利华动物有限公司的SCID-beige 小鼠。
1.1.2 主要试剂
Mesencult Media 购自STEM CELL 公司; 胎牛血清(FBS)、DMEM-F12 培养基购自Gibco 公司; 血清替代物(Knockout serum replacement)、 Knockout DMEM、谷氨酰胺、β-巯基乙醇、非必需氨基酸、双抗、人碱性成纤维生长因子(Basic fibroblast growth factor, bFGF)、分散酶(Dispase)和Ⅳ型胶原酶(Collagenase TypeⅣ)、胰酶、Hank’s 平衡盐溶液、 PBS 购自Invitrogene 公司; 明胶(Gelatin)购自Sigma 公司; 碱性磷酸酶(Alkaline phosophotase, AKP)检测试剂盒购自Vector Lab 公司; 胚胎干细胞鉴定试剂盒(ES Cell Characterization Kit)购自Chemicon 公司; PE 标记的小鼠抗人CD73、CD90、CD29、CD49b、 CD34 以及FITC 标记的CD14、CD45 购自BD pharmingen 公司。丝裂霉素C、地塞米松、β-磷酸甘油、 IBMX、胰岛素购自Sigma 公司。
1.2 方法
1.2.1 畸胎瘤形成
常规传代培养hESCs 的方法见文献[3], 机械切割法和酶消化法均可。将长至80%~90%融合的约5×106 HeSCs 通过酶消化法收集, 注射4 到8 周龄的SCIDbeige 小鼠后腿肌间隙, 经过约8 周后, 将SCID-beige 小鼠行断颈处死, 在无菌条件下取出畸胎瘤。
1.2.2 间充质干细胞(MSC)的获取
在无菌条件下, 将畸胎瘤剪碎, 37℃胰酶消化 20 min, 加入含有10%FBS 的Mesencult 培养基中止消化, 吹打至单细胞悬液, 450 r/min 离心5 min, 加含有10%FBS 的Mesencult 培养基培养于培养瓶中, 每天加bFGF 至10 ng/mL。待细胞长至90%汇合度后, 传代培养。
1.2.3 MSC 向成骨和成脂诱导
成骨诱导: 将长至80%左右汇合度的P3、P6 代细胞消化, 以1×104 个/cm2 的密度接种于24 孔板, Mesencult 培养基培养; 待细胞汇合度达95%左右时换为诱导培养基: 高糖DMEM、地塞米松(10−8 mol/L) 、β- 磷酸甘油(10 mmol/L) 、抗坏血酸(50 μg/mL)。每3~4 d 全量换液。对照孔用Mesencult 培养基培养。诱导4 周后用Von Kossa 法染色鉴定和碱性磷酸酶染色。成脂诱导: 将长至80%左右汇合度的P3、P6 细胞消化, 以1×104 个/cm2 的密度接种于24 孔板, Mesencult 培养基培养; 待细胞汇合度达 95%左右时换为诱导培养基: DMEM/F12、FBS(1%)、地塞米松(10−7 mol/L)、胰岛素(6 ng/mL)、IBMX (100 μg/mL)。每3~4 d 全量换液。对照孔用Mesencult 培养基培养。诱导3 周后用油红O 法染色鉴定。
1.2.4 流式细胞术检测MSC 表面标志
将P2 代或P7 代的MSCs 通过0.05%的胰酶消化收集, 用PBS 悬浮调整密度到1.0 至5.0×105 个/mL, 将细胞与CD105(SH2)、CD73( SH3 和SH4)、 CD90、CD45 和CD34 以及对照抗体室温孵育30 min, 用PBS 洗涤细胞两次, 用1%多聚甲醛固定细胞, 流式细胞术检测。
1.2.5 MSCs 作为滋养层细胞
将P3 或P7 代的MSCs 以及对照细胞MEF 细胞铺于六孔板中, 待其长至95%融合时, 用丝裂霉素 C 处理; 37℃、5%CO2 培养箱中处理2.5 h 后, 用 10%FBS 加DMEM培养基洗涤5 次, 加培养基过夜。第二天在将胚胎干细胞铺于滋养层细胞之前1 h 将培养基换成胚胎干细胞培养基。将传代的胚胎干细胞克隆团块铺于滋养层细胞之上, 加bFGF 至终浓度为10 ng/mL, 每日换液。
1.2.6 ES 细胞特异性抗原和核型鉴定
将hESCs 在MSCs 滋养层细胞上传代培养10 代以后, 用胚胎干细胞鉴定试剂盒进行鉴定。4%多聚甲醛室温固定30 min, 羊血清室温封闭抗原, 分别加入小鼠抗人SSEA-1(stage-specific embryonic antigen-1)、SSEA-4、TRA-1-60、TRA-1-81 单克隆抗体染色37℃孵育1 h 后, 加入荧光标记的羊抗小鼠二抗, 37℃孵育30 min, PBS 洗涤后, 荧光显微镜观察。按照说明书用碱性磷酸酶(AKP)检测试剂盒染色检测。常规行G 显带核型鉴定。
1.2.7 反转录PCR 实验检测ES 细胞特异转录因子
收集hES 细胞进行常规RNA 抽提和反转录PCR, GAPDH 引物上游序列: AATCCCATCACCATCTTCCA, 下游序列: TGAGTCCTTCCACGATACC AA; Oct4 引物上游序列: AAGGGCAAGCGATCAA GC, 下游序列: GGAAAGGGACCGAGGAGTA; Nanog 引物上游序列: CCTATGCCTGTGATTTGTGG, 下游序列: GAAGTG GGTTGTTTGCCTTT。复性温度均为57℃。
1.2.8 ES 细胞体内外分化能力检测
将ES 细胞在体外悬浮培养进行EB 形成试验测试其体外分化能力检测; 将ES 细胞进行SCID-beige 小鼠体内畸胎瘤试验测试其体内分化能力检测。
2 结果与分析
2.1 畸胎瘤形成
在将hESCs 注射入SCID-beige 小鼠后腿肌间隙后, 在第4 周的时候可以明显看到肿块隆起, 在第8 周取出畸胎瘤。
2.2 MSCs 的培养
原代MSCs 48 h 后可见许多细胞贴壁, 细胞形态多为圆形, 偶见短梭形细胞。第2~3 d 可见由几个短梭形细胞组成的小集落, 散在分布的细胞形态多呈短梭形或多角形, 个别细胞宽大扁平。3~5 d 后细胞生长加速, 7 d 左右接近汇合, 此时细胞形态多为梭形, 核居中, 可见2~3 个核仁。传代后的细胞24 h 内完全贴壁并伸展为梭形, 均匀分布生长, 2~3 d 即可传代一次,细胞以梭形为主(图1)。
图1 MSC 形态
A: 原代MSC; B: 第5 代MSC (×10)。
Fig. 1 Phase contrast image of MSCs
A: Primary MSCs culture; B: MSCs culture, passage 5 (×10).
2.3 MSCs 向成骨诱导
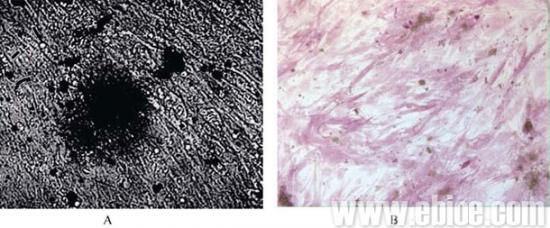
MSCs经在成骨诱导培养基中培养1 周后, 可观察到少许MSCs 细胞形态发生变化, 由梭形向多角形转变, 并且随时间推移越来越多, 聚集成团。3 周后, 观察到较大的细胞结节。在第4 周, 用Von Kossa 法染色可以看到黑色结节, 表明钙沉积的情况。成骨细胞因包埋在钙化基质中所以细胞轮廓不清楚。碱性磷酸酶活性是成骨细胞分化成熟的重要标志之一, 在诱导第2 周时, 经染色后表现为强阳性。对照组染色结果为阴性(图2)。
图2 MSC 成骨诱导染色
A: Von Konssa 染色显示钙结节(×20); B: 碱性磷酸酶显示阳性(×10)。
Fig. 2 Staining of MSCs after osteogenic induction
A: Vonkonssa staining shows mineralization deposits (×20); B: Alkaline phosphatase staining (×10).
2.4 MSCs 向成脂诱导
MSCs在成脂诱导培养基中培养1 周后, 细胞胞质内开始出现微小脂滴; 随着时间推移, 脂滴数目逐渐增多, 并且脂泡开始长大。第3 周时, 可以观察到细胞内出现富集的脂质小泡(图3)。油红O 染色法显示脂滴呈橙红色, 胞核显示蓝色。对照组未见脂滴。
图3 MSC 成脂诱导
A: MSC 经诱导形成的脂泡(×40); B: 油红O 法染色显示红色脂滴(×10)。
Fig. 3 Staining of MSCs after adipogenic induction
A: Lipid vacuole in MSCs (×40); B: Oil red O staining shows redadipocyte.
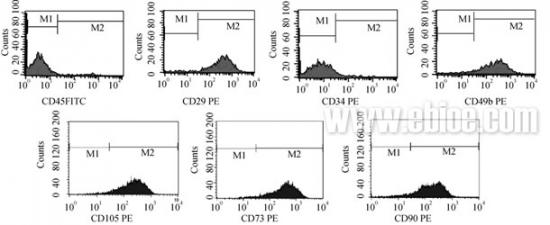
2.5 流式细胞术检测MSCs 表面标志
流式细胞术检测MSCs 表面标记显示CD45 和 CD34 阴性, 而P3 至P7 的MSCs 约85%到97%显示 CD29、CD49b、CD105(SH2)、CD73( SH3 和SH4)、 CD90 阳性。其他的非阳性的细胞可能是已分化的 MSCs 或其他尚未分化的干细胞(图4)。
图4 流式细胞仪检测MSCs 的表面抗原标记
Fig. 4 Expression of surface markers of MSCs analyzed by flow cytometry
2.6 培养在MSCs 滋养层细胞上的胚胎干细胞
将hESCs 传代至MSCs 滋养层细胞上后, 细胞依然呈圆形克隆性生长, 并且保持未分化状态。克隆边界清楚, 生长状态良好。与培养在MEF 滋养层上的对照组相比, MSCs 滋养层上的hESCs 生长速度较慢。经连续传代培养, 其克隆形态未发生明显变化(图5)。
图5 hES 细胞的生长状况
A: 生长在MEF 滋养层上的hESCs(×10); B: 生长在MSC 滋养层上的hESCs(×10)。
Fig. 5 Growth of hESCs
A: hESCs grown on MEF feeder cells (×10); B: hESCs grown on MSC feeder cells (×10).
2.7 胚胎干细胞表面标记物和特异性转录因子鉴定
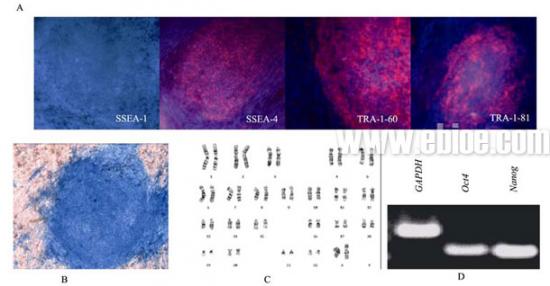
将培养在MSCs 滋养层上的胚胎干细胞经连续传代10 代后, 进行SSEA-1、SSEA-4、TRA-1-60、TRA-1-81 免疫荧光鉴定, 结果显示SSEA-1 阴性, SSEA-4、TRA-1-60、TRA-1-81 阳性。经碱性磷酸酶染色鉴定, 显示碱性磷酸酶阳性。G 显带核型分析显示为正常核型46, XX。通过反转录PCR 证实了 hES 细胞特异性转录因子Oct4 和Nanog 基因的表达 (图6), 表明其细胞全能特性未变。
图6 hES 细胞的鉴定
A: SSEA -1 染色阴性, SSEA-4、TRA-1-60、TRA-1-81 染色阳性(×10); B; 碱性磷酸酶染色阳性(×10); C; 核型鉴定正常; D; RT-PCR 显示hES 细胞正常表达Oct4 和Nanog。
Fig. 6 Characterization of hESCs
A: Staining of hESCs shows negative in SSEA-1, and positive in SSEA-4, TRA-1-60, and TRA-1-81 (×10); B: Alkaline phosphatase staining of hESCs shows positive (×10); C: Karyotype analysis shows normal; D: Electrophoresis of hESCs specific transcription factors.
2.8 分化能力检测
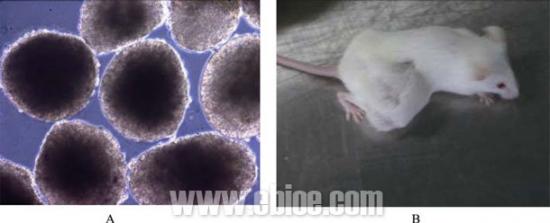
培养在MSCs 滋养层细胞上的hES 细胞体外分化能形成EB, 体内分化能形成畸胎瘤(图7), 表明了培养在MSCs 上的hESCs 具有全能分化潜力
图7 hES 细胞分化能力检测
A: 在体外培养形成EB; B: 体内分化形成畸胎瘤。
Fig. 7 The pluripotency of hESCs
A: hESCs form EB in vitro; B: hESCs form teratoma in SCID mouse.
3 讨 论
人胚胎干细胞由于其潜在的巨大应用价值而成为当今重要的研究对象。目前大多数胚胎干细胞系都是在鼠源性的MEF 滋养层上培养。通过这种滋养层细胞建立和培养的胚胎干细胞系存在着动物源性蛋白, 并且可能会被感染性的动物源性病毒如逆转录病毒污染, 因此极大的限制了这些细胞株对于临异体基因来源的细胞仍存在一定的交叉污染危险。
床用途的潜在价值[2]。因此, 许多新的胚胎干细胞系试图建立在无外源物质的培养体系中。目前, 科学家们尝试了一些使用人源滋养层细胞来培养胚胎干细胞系, 如人骨髓来源的间充质干细胞[4]、胎儿肌肉或胎儿皮肤细胞[5]、新生儿包皮成纤维细胞[6]、成人子宫内膜细胞[7]、人胎盘成纤维细胞[8]。然而, 各种不同的来源的细胞具有不同的能力以支持 hESCs 的生长, 并不是所有人源细胞都能很好地支持hES 细胞的生长, Richards 等[9]比较了几种不同的人源滋养层细胞, 发现培养效果相对MEF 要差。用人源滋养层细胞比如胎儿组织存在很多伦理问题, 而且用Carpenter 等[10]建立了hES 细胞无饲养层培养体系, 以及Li 等[11]发现无饲养层细胞无血清的培养体系亦可以成功的维持hES 细胞的生长。对ES 细胞自体来源滋养层的研究, 研究报道从ES 细胞自体分化得到的成纤维细胞也具有支持ES 细胞未分化生长的能力, 这不仅在hES 细胞的研究中得到了该结论[12~14], 在老鼠的ES 细胞中也得到了相似的结果[15]。
近来的研究报道了多种hES 细胞经体外自发分化[16]或者与OP9 细胞共培养[17]而获得高纯度MSCs 方法。我们的研究表明, 将hES 细胞注射入重症免疫联合缺陷小鼠形成畸胎瘤, 再从畸胎瘤中可以得到高纯度的类似的MSCs。畸胎瘤是由hES 细胞在体内分化而来, 是具有三个胚层来源的细胞混合体。Mesencult 培养基能够在细胞体外培养时纯化扩增和培养MSC。我们在将原代的畸胎瘤剪碎和消化后, 用Mesencult 培养基在体外进行传代纯化培养, 经过数代的纯化, 经流式细胞术检测其细胞表面特异分子抗原、成骨和成脂细胞诱导等实验证实该 MSC 具有85%以上的细胞纯度。从hES 细胞经体内分化得到大量的纯度较高的MSCs, 这对于将来研究 MSCs 的生物学特性和治疗用途都具有重要的意义。
这些来源于胚胎干细胞本身的MSCs, 由于经过了在重症免疫联合缺陷小鼠形成畸胎瘤的阶段, 所以从一定程度上减少了这些MSCs 潜在的病毒污染的可能性。因为如果有可能的病毒污染, 则会导致重症免疫联合缺陷小鼠的死亡, 从而hES 细胞在重症免疫联合缺陷小鼠身体内无法获得畸胎瘤。
这些来源于hES 细胞本身的MSCs 可以被用来作为支持hES 细胞生长并维持其未分化状态的滋养层细胞。这些MSCs 可能像MEF 一样, 可以分泌一些维持hES 细胞未分化状态和促进其生长的因子。通过对培养于MSCs 上的hES 细胞进行特异性转录因子Oct4、Nanog 的反转录PCR 和hES 细胞特异性抗原染色, 证实了hES 细胞的全能性指标。
和其他人源性的滋养层细胞的研究相比, 本研究中使用的滋养层细胞是来源于人胚胎干细胞本身。因此具有来源取材方便, 在一定程度上减少了外源物质污染的风险等优点。MEF 细胞作为滋养层通常只能限定在5 代以内, 否则无法很好的维持 hESCs 的生长, 并且随着代次增多其扩增能力减退。而从hESCs 本身来源的MSCs 具有干细胞的特性, 可以得到大量的扩增, 并且不同代次之间对于维持 hESCs 生长没有明显差别。
本研究从hES 细胞在SCID-beige 小鼠体内形成的畸胎瘤中分离得到了MSCs, 考虑到畸胎瘤的生长所需要的养份均由鼠提供, 当畸胎瘤生长到一定大小时还有可能出现血管。因此在分离的MSCs 中是否会有鼠的MSCs 存在, 我们对此进行了MSCs 的体外培养和大量的核型鉴定, 证明该MSCs 确实是来源于人, 而没有混入鼠的MSCs。
总之, 我们证明了来源于hES 细胞体内分化而来的MSCs 能够作为滋养层支持hESCs 的生长和维持其未分化状态, 但具体机制及对hESC 的长期影响尚需进一步研究。我们的工作为获取MSCs 提供了一个新的途径, 为hES 细胞培养中滋养层细胞的来源提供了一个新的思路。