1 材料
成年同龄雄性新西兰白兔 2 只,体重约2.5~3 kg(购于南京军区南京总医院动物实验中心),一只为正常成年雄性新西兰白兔,一只为膀胱出口不全梗阻8 周成年雄性新西兰白兔。DMEM、Ⅱ型胶原酶及α-平滑肌肌动蛋白抗体(α-SMA);胎牛血清购于杭州四季青公司;胰蛋白酶。
2 方法
2.1 膀胱平滑肌细胞酶法分离
肌注盐酸氯胺酮 200 mg及氟哌利多5 mg麻醉,待兔进入麻醉状态后消毒,下腹正中切口,迅速切取膀胱组织。超净台内依次庆大霉素溶液(浓度为100 单位/毫升)、生理盐水及D-Hanks’液中浸泡洗涤5 分钟,然后放入D-Hanks液中除去黏膜、黏膜下及浆膜层。肌肉剪成肉糜后0.1%Ⅱ型胶原酶(2 mg/mL) 溶液40 过夜消化(约10-12 小时)。然后加0.25%胰蛋白酶370 消化30 分钟,消化液变混浊呈絮状提示消化良好。用100 目细胞筛过滤该絮状液,混悬液离心(1000 转/分,离心半径13 cm)5 分钟,沉淀的细胞移入培养皿,加入含10%胎牛血清的DMEM,置于50 mL/L CO2、37℃饱和湿度孵育箱中静置培养,培养液每周更换2-3 次。
2.2 传代培养
待培养的细胞通过增殖达到约 80%汇合状态时做传代处理。弃去原培养瓶中的旧培养液,加入适量的PBS(因培养液中的胎牛血清对胰蛋白酶有抑制作用),轻轻摇动,清洗残留的培养液后弃之。加入适量的消化液,使其覆盖整个细胞,将培养瓶放置于CO2培养箱,不时在倒置显微镜下观察,当细胞胞质回缩,胞间间隙增大后,吸出消化液,并向培养瓶中加入含10%胎牛血清的培养液终止消化。用吸管吸取培养瓶中的培养液,反复吹打瓶壁制备细胞悬液,吹打时不能用力过猛,尽量不出现气泡,以免损伤细胞。细胞进行计数后,按照1X105~106细胞/mL密度将细胞接种于培养瓶中。
2.3 培养细胞的观察及鉴定
采用倒置显微镜观察平滑肌细胞的形态及生长情况。细胞爬片 HE 染色观察细胞形态。电镜检查。免疫组化染色检测α-SMA。
3 结果
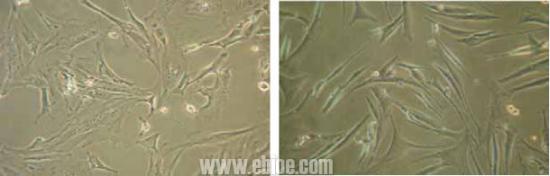
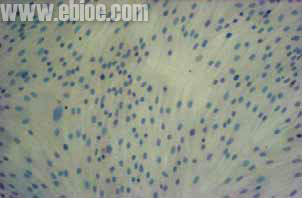
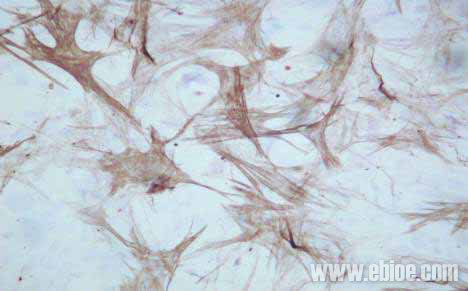
两只兔所有标本均获成功。倒置显微镜观察平滑肌细胞24 小时均可见膀胱平滑肌细胞贴壁生长,正常兔7 天左右、而梗阻兔则需10~12 天可于50 毫升培养瓶约80%汇合。均传代顺利,传代后约正常兔6天左右、而梗阻兔需 8~9 天可于50 毫升培养瓶约80%汇合。本组中均传至第8 代,经第8 次传代后,平滑肌细胞仍生长迅速,未见衰老迹象。倒置显微镜下观察均呈“谷和峰”样结构(图1 中对照组2 周的细胞;图2 中实验组培养2 周的细胞)。细胞爬片HE 染色见膀胱平滑肌细胞细胞核呈两端钝圆的卵圆形平滑肌细胞核型(见图3)。电镜检查可见平滑肌细胞密班结构(图4)。免疫组化染色检测α-SMA 呈阳性反应(图5)。从细胞爬片HE 染色和免疫组化染色检测α-SMA 呈阳性反应中我们发现该方法所的膀胱平滑肌细胞的纯度几乎99%。
图1.对照组2周的细胞 图2.实验组培养2周的细胞
图3.细胞爬片HE染色见膀胱平滑肌细胞 细胞核呈两端钝圆的卵圆形平滑肌细胞核型
图4.分离后培养细胞的电镜检查发现平滑肌细胞致密斑结构
图5. α-SMA免疫组化证实该方法能获得单一膀胱平滑肌细胞(棕色为α-SMA阳性)
4 讨论
平滑肌细胞的培养方法可分为两类:组织块法和酶消化法。组织块法适用于细嫩、易碎的组织;其方法较简单;但容易产生杂质如成纤维细胞等,成纤维细胞生长快,故培养之细胞质量较差;培养的大多数细胞无收缩性;且原代细胞的获得需3-4 周,获得大量平滑肌细胞耗时长[1]。既往酶消化法较组织块法复杂、精细;适宜的酶浓度和培养时间的确定较为困难;然而在较短时间内可获得大量的平滑肌细胞,1996 年Chambers等[2]报道酶消化法纯度为70%。可见一种快速、高效、高纯度的酶消化法培养膀胱平滑肌的方法显得尤为重要。
本实验研究两只兔所有标本均获成功。倒置显微镜观察平滑肌细胞 24 小时均可见膀胱平滑肌细胞贴壁生长,正常兔7 天左右、而梗阻兔则需10~12 天可于50 毫升培养瓶约80%汇合。均传代顺利,传代后约正常兔6 天左右、而梗阻兔需8~9 天可于50 毫升培养瓶约80%汇合。本组中均传至第8 代,经第8 次传代后,平滑肌细胞仍生长迅速,未见衰老迹象。倒置显微镜下观察均呈“谷和峰”样结构。细胞爬片HE染色见膀胱平滑肌细胞细胞核呈两端钝圆的卵圆形平滑肌细胞核型。电镜检查可见平滑肌细胞密班结构。免疫组化染色检测α-SMA呈阳性反应。从细胞爬片HE染色和免疫组化染色检测α-SMA呈阳性反应中我们发现该方法所的膀胱平滑肌细胞的纯度几乎99%(在以下的膀胱平滑肌细胞的共聚焦检测中也证实了这一点)。膀胱平滑肌的鉴定[3]主要根据其细胞形态及α-actin的检测。倒置显微镜下观察均呈“谷和峰”样结构;细胞爬片HE染色见膀胱平滑肌细胞细胞核呈两端钝圆的卵圆形平滑肌细胞核型;电镜检查可见平滑肌细胞密班结构,这些细胞形态学的检测均证实其为膀胱平滑肌细胞。免疫组化染色检测α -SMA呈阳性反应更进一步证实了该方法所获得的细胞为膀胱平滑肌细胞。已有学者通过实验发现:酶消化法获得的膀胱平滑肌细胞细胞膜通道的密度有所下降;细胞膜电位和细胞膜电阻稍微降低。他们认为通过酶消化法所获得的膀胱平滑肌细胞经培养、传代后仍基本保持着原有的电生理特性,由此在体外研究的结果可较好的反映体内情况[4,5]。梗阻后的膀胱平滑肌细胞在生长扩增中明显较正常膀胱平滑肌细胞时间长,也说明了这种酶消化法对膀胱平滑肌细胞的影响不是太大,还是保留着体内的基本特性。在我们的激光扫描共聚焦显微镜的检测中平滑肌细胞内的钙离子荧光强度在M受体激动剂的影响下发生明显变化,这更进一步证实了该方法分离培养出的膀胱平滑肌仍保持着收缩功能。
从实验研究中我们体会到该方法:(1)简便、易行、易掌握及短期内可获大量高质单个膀胱平滑肌细胞;(2)应严格无菌操作;(3)仔细彻底剥除膀胱黏膜、黏膜下及浆膜层,是确保获的大量高质单个膀胱平滑肌细胞的基础;(4)膀胱平滑肌组织应尽量减碎以确保充分消化; (5)严格控制胶原酶和胰蛋白酶的浓度和消化时间,见消化液混浊、组织块呈絮状,或在倒置显微镜下见消化液中有较多单个细胞或细胞小团块时即终止消化;(6)细胞筛的运用也是获得高质单个膀胱平滑肌细胞的基础。
参考文献
1. Korkmaz M, Guvenc BH, Bilir A et al. Isolation and culture of adult and fetal rabbit bladder smooth
muscle cells and their interaction with biopolymers. J Pediatr Surg. 2003;38(1):21-24.
2. Chambers P,Neal DE,Gillespie JI. Ca2+ signalling in cultured smooth muscle cells from human bladder.
Exp Physiol 1996;81(4):553-564.
3. ChamLey CJ,Campbell GR,Ross R.The smooth muscle cells in culture. Physiol Rev
1979;599(1):1-61.
4. Sui GP, Wu C, Fry CH .A description of Ca2+ channels in human detrusor smooth muscle. BJU Int.
2003; 92(4):476-478.
5. Sui GP, Wu C, Fry CH. The electrophysiological properties of cultured and freshly isolated detrusor
smooth muscle cells. J Urol. 2001;165(2):627-632.