大鼠视神经少突胶质细胞培养
(原文:视神经少突胶质细胞体外培养纯化及鉴定)
彭锡嘉 刘少章 叶剑 袁容娣
【摘要】 目的 探讨新生2d Wistar大鼠视神经少突胶质细胞的分离方法和生长条件,为视神经损伤修复及少突胶质细胞疾病的研究奠定基础。方法 采用视神经,DMEM/F12条件培养基培养,观察细胞形态及生长,并进行免疫组织化学鉴定。结果 3d后观察,细胞自视神经周围迁出,呈圆形或梭形;11d左右,细胞基本铺满盖玻片。免疫组织化学半乳糖脑苷脂(galactocerebroside,GC)染色阳性,纯度较好。结论 本课题建立的少突胶质细胞培养方法,可获得纯化的少突胶质细胞,能满足进一步的实验需要。
【关键词】 少突胶质细胞;视神经;细胞培养
2000年,抑制神经再生基因-Nogo被发现,其编码的蛋白Nogo-A仅表达于少突胶质细胞,对中枢神经再生具有强烈的抑制作用[1]。开展少突胶质细胞的体外培养,可为进一步研究视神经的损伤修复及少突胶质细胞相关疾病奠定基础。但体外培养的少突胶质细胞成熟后增殖缓慢或不再增殖,培养困难[2]。我们采用新生2d的Wistar大鼠视神经培养获取了纯化的少突胶质细胞,现报道如下。
1.材料和方法
1.1 DMEM/F12条件培养液(亚硒酸钠40μg·L-1,腐胺16.2 mg·L-1,转铁蛋白100 mg·L-1,胰岛素234U·L-1,甲状腺素0.4μg·L-1,黄体酮0.62 mg·L-1,谷氨酰胺3g·L-1)。DMEM/F12培养基、小牛血清购自Hyclone公司,兔抗鼠GC抗体、亚硒酸钠、腐胺等购自Sigma公司。
1.2 视神经胶质细胞的来源、培养 取新生2d的Wistar大鼠10只(第三军医大学大坪医院野战外科研究所动物中心提供),无菌条件下取出双侧视神经。接种至24孔培养板内经多聚赖氨酸处理的盖玻片上。而后加入含30g·L-1小牛血清的DMEM/F12培养基,37°C,50mL·L-1 CO2,100%湿度连续培养3d。3d后弃废液,改为含5g·L-1小牛血清DMEM/F12条件培养液继续培养。每周换液2次。在获得足够的细胞数量后,改用无血清条件培养液继续培养,每2d换液一次。
1.3 形态学观察:每天在倒置显微镜(日本Olympus),观察培养细胞的生长过程和形态学变化并拍照。
1.4 免疫细胞化学鉴定:将含细胞盖玻片取出,0.01mol·L-1 PBS冲洗3次×5min;冷丙酮固定10 min;PBS冲洗(3次×5min);30g·L-1过氧化氢室温孵育15min;PBS冲洗3次×5min;滴加正常山羊血清,室温孵育20 min;滴加1:100 GC抗体,阴性对照以PBS代替一抗,37°C孵育60min;PBS冲洗3次×5min;滴加生物素标记羊抗兔IgG,37°C,20min;PBS冲洗3次×5min;滴加辣根酶标记链酶卵白素工作液;DAB工作液(武汉博士德公司)显色,自来水终止反应;脱水,透明,D·P·X封片保存。
2 结果
2.1 形态学观察结果
组织块24h开始贴壁,48~72h可见神经组织边缘游出少量细胞,主要为圆形或梭形(图1)。8~9d左右,细胞基本铺满培养孔。此时改用无血清条件培养基培养进行纯化。培养过程中,部分细胞死亡。12d左右获得的细胞胞体基本为呈圆形或多角型,直径约6~10μm。细胞核较大,胞质少(图2)。
2.2 免疫组织化学染色结果
培养的视神经少突胶质细胞的免疫组织化学染色GC蛋白阳性,未加一抗的呈阴性。染色结果显示成熟的少突胶质细胞突起丰富,互相形成蜘蛛网状(图3)。苏木素复染,异质细胞较少,90%以上为阳性细胞(图4)。
3 讨论
抑制神经再生基因Nogo的发现为视神经损伤的修复、视功能保护研究带来了希望。视神经胶质细胞包括星形胶质细胞和少突胶质细胞2种类型,分化不同,功能各异。成熟的少突胶质细胞不再具有分裂增殖能力,为分裂终期细胞[2],培养较为困难。
1980年McCarthy[3]等建立了从脑灰质组织分离、纯化星形胶质细胞和少突胶质细胞的分离培养模型。目前国内外多采用该法[4]。利用少突胶质细胞和星形胶质细胞贴壁能力的不同采用振动分离法进行分离、培养。此法主要用来获取星形胶质细胞,获得的少突胶质细胞较少。存在着操作步骤多容易被污染、分离过程中因振荡离心易造成机械性损伤导致细胞死亡等缺点。
本实验采用视神经组织块培养的方法,对新生大鼠的视神经胶质细胞进行条件化原代培养,利用少突胶质细胞和星形胶质细胞生长条件的不同,采用条件培养基纯化2种细胞。少突胶质细胞和Ⅱ型星形胶质细胞是从一种普通双潜能的少突胶质细胞-2型星形胶质细胞祖细胞(oligodendrocyte-type-2astrocyte progenitor cell,O2A)发育而来[2]。大鼠出生后约1周,少突胶质细胞逐渐成熟。因此,从新生大鼠取材可获得O2A祖细胞。体外研究发现甲状腺素、胰岛素、转铁蛋白、腐胺、黄体酮和微量元素硒等,可使O2A祖细胞朝少突胶质细胞定向分化。而血清等可以诱导O2A祖细胞分化为Ⅱ型星形胶质细胞[2、5]。我们利用这一特点,逐步减少条件培养基中的血清浓度,促进O2A祖细胞向少突胶质细胞分化。最终采用无血清条件培养基,抑制星形胶质细胞及其它异质细胞增殖,而少突胶质细胞在此条件下则基本不受影响。GC是表达于少突胶质细胞膜以及髓鞘的一种主要类脂,它是识别少突胶质细胞普遍应用的特异性化学标志物[2、4]。
免疫染色鉴定结果表明纯度较高超过90%。此方法简便、可靠、易于推广,便于对少突胶质细胞相关课题进行研究。>
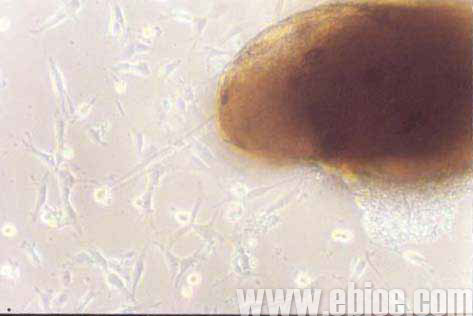
Figure 1 Cells migrated from optic nerve tissue at the third day (10×10)
图1 培养第3天,细胞自视神经迁出 (10×10)
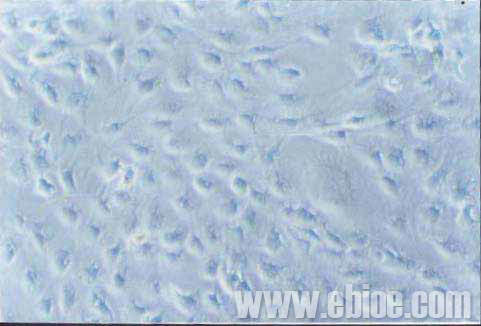
Figure2 Purified oligodendrocytes of optic nerve at the fifteenth day (10×40)
图2 培养第15天,纯化的视神经少突胶质细胞(10×40)
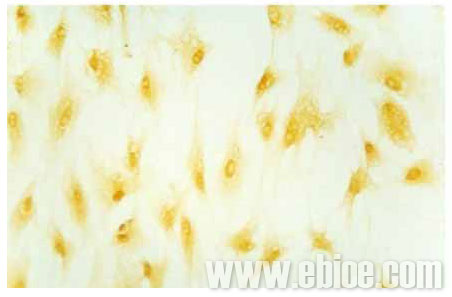
Figure 3 Positive expression of GC in oligodendrocytes at the seventh day (10×20)
图3 培养第7天,少突胶质细胞GC阳性表达 (10×20)
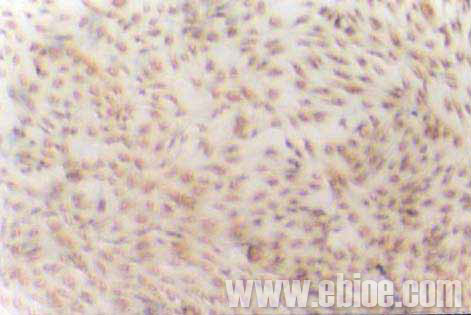
Figure 4 Positive expression of GC in purified oligodendrocytes
at the fifteenth day (hematoxylin staining) (10×20)
图4 培养第15天,纯化的少突胶质细胞GC阳性表达(苏木素复染)(10×20)
>
参考文献
1.Goldberg JL,Barres BA. Nogo in nerve regeneration [J]. Nature 2000; 403(6768): 369-70.
2.何平,沈馨亚. 少突胶质细胞增殖和分化的研究进展[J]. 神经解剖学杂志2000;16(2):183-188.
3.McCarthy K D, DeVellis J. Preparation of separate astroglial and oligodendroglia cell cultures from rat cerebral tissue [J]. J Cell Biol 1980; 85: 890-902.
4.伍亚民,马海涵,廖维宏. 大鼠星形胶质细胞和少突胶质细胞的纯化培养与鉴定[J].创伤外科学2000;4:207-209.
5.Raff MC, Miller RH, Noble M. A glial progenitor cell that develops in vitro into an astrocyte or an oligodendrocyte depending on culture medium [J]. Nature 1983; 303(5916): 390-6.
Culture,purification and identification of oligodendrocytes
of newborn rats optic nerve in vitro
Peng Xi-Jia, Liu Shao-Zhang, Ye Jian, Yuan Rong-Di.
[Abstract] Objective To investage the separation method and growth condition of oligodendrocytes from newborn Wistar rats optic nerve for further research of repair of optic nerve injury and related diseases of oligodendrocytes. Method Optic nerves from newborn rats were used as material and DMEM/F12 chemically defined culture medium to cultivate oligodendrocytes. The morphologic and growth changes of the cells was observed, then the cells was marked by specific galactocerebroside(GC) antibody through immunocytochemical examination. Results A few of round or fusiform cells migrated from optic nerve at the third day. The cover slips were overgrowed about 11days later. Immunocytochemical examination showed that the cells obtained by this method were positive cells. Conclusion Oligodendrocytes cultured by the method were purified cells and can meet the demands of further reaseach.
[Key words] oligodendrocytes; optic nerve; cell culture







