1细胞低血清培养介绍
1.1 细胞的体外培养
细胞培养是指细胞在体外条件下的存活或生长,是一种应用最为广泛的体外培养技术。由于体外培养技术最初是从培养组织发展而来的,所以动物学和医学上往往用“组织培养”这一术语来泛指一切可以使细胞、组织、器官在适当的培养条件下离体生长的技术。动物组织培养的技术起源于19 世纪所应用的若干胚胎学技术。1885 年W.鲁把鸡胚的神经板在温热的盐水中成功地维持存活了若干天,是首次体外培养的尝试。1907 年美国胚胎学家R.G.哈里森的实验是组织培养真正开始的标志,他把蛙胚神经管的一小片组织移植到蛙的凝结的淋巴液中,这小片组织不但在体外存活了若干星期,还从细胞中长出了轴突,从而解决了关于轴突起源的争论,表明了利用体外存活组织进行实验的可能性。随后,法国生物学家A.卡雷尔把外科无菌技术引进组织培养技术,他从一个鸡胚心脏组织开始,将不断铺出和增殖的细胞系统地传代,在完全没有抗菌素的条件下维持了34 年。随着抗菌素、合成培养液、胰蛋白酶处理技术的发展以及器皿的改进,动物组织培养技术得到了飞速的发展。其间,W.厄尔首创了从单个细胞进行克隆培养的方法,并第一次有意地进行了悬浮培养的尝试;盖伊等于1952 年建立了最早的上皮型的人的连续性细胞系之一即人子宫颈癌细胞系(HeLe细胞系)。作为现代生物技术的核心基础技术,细胞培养技术广泛用于生物技术的各个领域,特别是现代生物医药技术领域,目前,绝大多数的疫苗、抗体、重组基因工程蛋白类药物等生物医药产品的生产均依赖于细胞培养技术。
1.2 血清在细胞培养中的作用
血清对于在传统培养基配方中生长和增殖的大多数细胞系来说是需要的,因为大多数单独的培养基并不能提供细胞生长所需要的全部营养,如MEM培养基,较为常用的量为8%~10%的比例,而特殊的低血清培养基血清量可降至3%左右,细胞的形态和功能不受影响。用于细胞培养的血清主要是牛血清,培养某些特殊细胞也用人血清、马血清等。选择用牛血清培养细胞的原因主要是来源充足、制备技术成熟、经过长时间的应用考验人们对其有比较深入的理解。牛血清分为小牛血清、新牛血清、胎牛血清。小牛血清取自出生10~30天的小牛;新牛血清取自出生24 小时之内的新生牛;胎牛血清应取自剖腹产的胎牛。显然,胎牛血清是品质最高的,因为胎牛还未接触外界,血清中所含的抗体、补体等对细胞有害的成分最少。牛血清对绝大多数哺乳动物细胞都是适合的,但并不排除在培养某种细胞时使用其他动物血清更合适。牛血清中含有丰富的细胞生长必须的营养成份,具有极为重要的功能。血清是非常复杂的混合物,成分多样,有的对细胞生长有促进作用:提供基本营养物质,如氨基酸、维生素、无机物、脂类物质、核酸衍生物等,是细胞生长必须的物质;提供激素和各种生长因子,如胰岛素、肾上腺皮质激素、类固醇激素(雌二醇、睾酮、孕酮)、成纤维细胞生长因子、表皮生长因子、血小板生长因子等;提供结合蛋白,可携带重要的低分子量物质,如白蛋白携带维生素、脂肪、以及激素等,转铁蛋白携带铁,在细胞代谢过程中起重要作用;血清能提供促接触和伸展因子,使细胞贴壁免受机械损伤,对培养中的细胞起到某些保护作用;血清中还含有起稳定作用和解毒的因子,能够维持培养基的pH 值并抑制蛋白酶直接或间接的酶解。血清还能够帮助细胞粘附到培养表面,可能通过提供粘附过程涉及的外源糖蛋白起作用。
但是血清的加入也带来了很多问题:血清的成份可能有几百种之多,目前对其准确的成份、含量及其作用机制仍不清楚,尤其是对其中一些多肽类生长因子、激素和脂类等尚未充分认识,这给研究工作带来许多困难; 血清都是批量生产,各批量之间差异很大,因此,要保证每批血清的相似性极为困难,从而使实验的标准化和连续性受到限制;对大多数细胞,在体内状态,血清不是它们接触的生理学液体,只是在损伤愈合以及血液凝固过程中才接触血清,因此使用血清有可能改变某种细胞在体内的正常状态,血清可能促进某些细胞的生长(成纤维细胞)同时抑制另一类细胞生长(表皮细胞);血清含一些对细胞产生毒性的物质,如多胺氧化酶,能与来自高度繁殖细胞的多胺反应(如精胺、亚精胺)形成有细胞毒性作用的聚精胺,补体、抗体、细菌毒素等都会影响细胞生长,甚至造成细胞死亡;血清取材中可能带入支原体、病毒,对细胞产生潜在影响;大规模生产中,血清来源越来越困难,价格昂贵,是构成生产成本的主要部分之一。
1.3 细胞的低血清培养
在细胞培养过程中,血清浓度常常是可以降低到传统培养特定类型细胞的水平之下的,从而实现细胞的低血清培养。细胞经较低浓度的血清适应传代后,可适应低血清浓度而良好的生长,细胞的生长状态和生长速度没有明显影响。对于细胞的低血清培养技术,国际上在上世纪就有相关方面的研究。在我国,“低血清与无血清细胞培养技术的研究与应用”已被列入“十一五”国家科技支撑计划重点项目——动物疫苗关键生产技术研究与开发。
与传统的高血清含量的细胞培养相比较,使用低血清进行细胞培养具有明显的优点。在细胞的低血清培养基中,由于不含血清替代物、动物来源蛋白、以及植物蛋白、酵母水解物,因此保证了细胞培养中原辅料的使用安全性;在细胞培养阶段不需要使用水解乳蛋白,支持低血清培养,可使血清含量可降低到3%~5%,显著降低培养液成本并提高产品质量;在低血清培养状态下,虽然降低了血清的使用量,但细胞更易培养,细胞生长速度快、形态健壮、活力更强。
1.4 BHK21 细胞的低血清培养
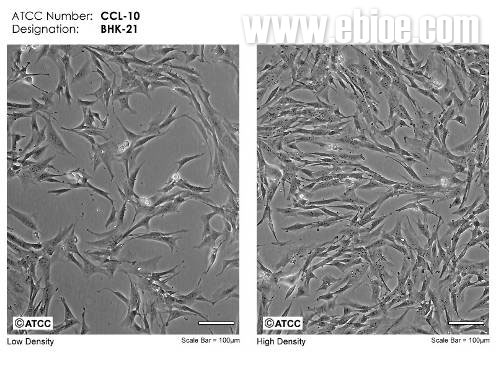
BHK21 细胞是幼年叙利亚地鼠肾细胞(Baby Hamster Syrian Kidney )。1961 年3 月,I.A. Macpherson 和 M.G.P. Stoker 从一日龄叙利亚地鼠肾分离建株,经过84 天连续培养,获得单细胞克隆细胞,即clone 13 或C13。BHK21 细胞广泛用于增殖各种病毒,已成为制备口蹄疫疫苗所需病毒抗原的理想细胞培养系,应用于口蹄疫疫苗生产,之外还可用于生产狂犬疫苗等其它兽用疫苗。BHK21 细胞染色体分布频率是n=44,为异双倍体细胞系,4 倍体发生率为4%,大多数细胞核型分析为44,XY,-6,-15,6q+,15q+。原始的BHK21 细胞株为成纤维细胞,属于贴壁依赖性细胞,后经无数次传代后细胞可悬浮生长。
美国ATCC保存BHK21细胞株,编号为 CCL-10,为C13 克隆株。对于BHK21细胞, ATCC 推荐使用的培养方式为:使用含10%胎牛血清的MEM 培养基进行细胞培养,细胞培养温度为37.0°C,细胞培养后使用0.25%胰酶和0.03 %EDTA消化细胞,细胞分种比例为1:2-1:10,每周1-2 次细胞传代。
ATCC提供的BHK21细胞培养照片
BHK21细胞可使用方瓶或转瓶进行细胞培养,对于生物制药企业,多使用15L转瓶进行细胞培养。转瓶生产制备BHK21细胞的主要问题在于如何避免污染,以及细胞良好生长与传代。与原代细胞以及二倍体细胞比较,BHK21细胞更容易控制与培养,由于BHK21细胞生长速度较快,可进行大比例分种培养。营养BHK21细胞转瓶培养效果的因素较多,比如细胞消化液的选择、细胞培养操作程序的使用,但做为重要的生物制药原材料,细胞培养基对细胞培养效果的重要性得尤为突出。细胞培养基不仅为细胞的生长提供必要的各种营养成分,还为细胞培养提供适宜的环境,而且,在利用细胞进行生物制药时,培养基的成分可直接影响制药产品的质量。BHK21 细胞可使用多种细胞培养基进行培养,最广泛适用的培养基为MEM培养基,使用的血清含量为 10%。在转瓶生产口蹄疫疫苗中,常将乳汉液和MEM按1:1的比例混合进行细胞培养,该细胞培养方式是上世纪建立的方法,具有悠久的使用历史。然而该传统模式下制备的疫苗,往往生产成本较高,并且具有较严重的免疫接种副反应发生。随着生物技术的不断进步,人们对生物安全性的逐步重视,以及生物制药企业对生物制品的产率和生产成本提出了更高的要求,高浓度的血清以及水解乳蛋白在疫苗生产中的使用,所带来的产品质量和使用安全性问题,以及较高的生产成本问题,逐步显现出来。因此,在BHK21细胞生长中使用低浓度血清进行培养具有重要意义。
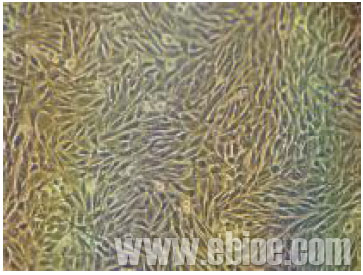
BHK21 细胞可使用清大天一的MD611 低血清培养基进行培养,血清含量可降低到2%-3% 浓度,可实现细胞的低血清培养,并可改善细胞的培养状态,更利于细胞的贴壁和生长,有助于生物制药领域中BHK21 大规模培养的效果提高和生产成本的显著降低。在使用BHK21 低血清培养基进行转瓶培养工艺中,由于培养基对细胞的培养特性有所改变,以及降低血清后而引起的细胞培养条件的改变,低血清培养的方式与传统培养基培养细胞方式相比较存在一定的差异,主要表现在细胞贴壁状态和细胞的生长状态,如降低血清后细胞更易漂浮,以及细胞生长代谢旺盛而引起的细胞培养液更易变酸,造成对细胞培养和传代效果影响,但这些都可以通过改变细胞培养的条件和控制培养条件加以改善,生物制药企业工业化规模在口蹄疫疫苗制备中的使用就是很好的例证。
BHK21细胞低血清培养照片(MD611培养基)
1.5 Vero 细胞的低血清培养
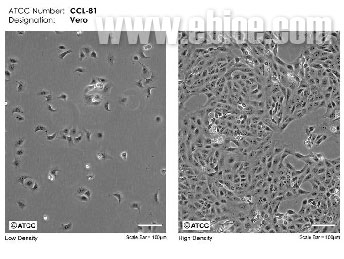
Vero细胞是成年非洲绿猴肾细胞(Adult African Green Monkey Kidney )。上皮细胞,贴壁依赖性生长。该细胞是日本千叶大学的Y. Yasumura和Y. Kawakita于1962年3月27日从一只正常的成年非洲绿猴肾组织培养出来的。其可增值多种病毒,如脊髓灰质炎、狂犬病毒、乙脑病毒等,生产疫苗,被批准用于人体。也可作为转染的宿主细胞,用于表达外源基因的蛋白质药物和病毒的检测。在非典期间又为研究冠状病毒做出贡献,在医药研究中广泛应用。美国ATCC保存Vero 细胞株,编号为CCL-81。对于Vero细胞, ATCC推荐使用的培养方式为:使用含10%胎牛血清的MEM培养基进行细胞培养,细胞培养温度为37.0°C,细胞培养后使用用 0.25% (w/v) 的胰酶和0.53 mM EDTA消化细胞,推荐的细胞分种比例为1:4,传代期间,每周更换培养液2~3次。 Vero细胞可使用方瓶或转瓶进行细胞培养,对于生物制药企业,多使用15L转瓶进行细胞培养。转瓶生产制备Vero细胞的主要问题在于如何避免污染,以及细胞良好生长与传代。与原代细胞以及二倍体细胞比较,Vero细胞更容易控制与培养,由于Vero细胞生长速度较快,可进行大比例分种培养。营养Vero细胞转瓶培养效果的因素较多,比如细胞消化液的选择、细胞培养操作程序的使用,但作为重要的生物制药原材料,细胞培养基对细胞培养效果的重要性得尤为突出。细胞培养基不仅为细胞的生长提供必要的各种营养成分,还为细胞培养提供适宜的环境,而且,在利用细胞进行生物制药时,培养基的成分可直接影响制药产品的质量。Vero细胞可使用多种细胞培养基进行培养,使用的血清含量通常为10%。
ATCC提供的VERO细胞培养照片
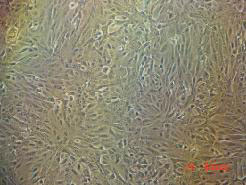
Vero 细胞经较低浓度的血清适应传代后,可适应低血清浓度而良好的生长,细胞的生长状态和生长速度没有明显影响。Vero细胞可使用清大天一的MD504 培养基或MD611 培养基进行低血清培养,使用的血清含量可降低到3%-5%。
Vero细胞低血清培养照片(MD504培养基)
1.6 影响细胞低血清培养的因素
由于在细胞培养过程中使用了低浓度的血清,细胞的低血清培养比常规血清培养更难控制,需要在培养过程中严格控制细胞培养条件和操作过程。影响细胞低血清培养效果的因素很多,包括细胞贴壁性、细胞的质量、细胞培养基、细胞培养条件控制、污染控制等方面。
1.6.1 细胞贴壁性
对于体外培养的细胞,按细胞贴壁的性质差异可分为两类,贴壁依赖性细胞和非贴壁依赖性细胞。贴壁依赖性细胞在培养时需要贴附在支持物表面生长,而非贴壁依赖性细胞可不依赖于支持物表面进行悬浮培养。对于贴壁依赖性细胞,细胞的贴壁伸展过程在细胞的生长增值中具有重要的作用。细胞在支持物表面的贴壁过程可分为三步,贴壁因子粘附、细胞开始粘附、细胞进一步牢固附着并伸展,同时细胞形态由圆形变为圆饼形(放射状铺伸细胞),并逐渐展开伸展为扁平的极性细胞。细胞伸展为扁平的极性细胞,有利于增加细胞于营养环境的营养物质交换表面积,之外只有当细胞伸展到合适状况,细胞DNA才开始合成,细胞伸展状况制约了细胞的分裂增殖活动过程。因此,细胞贴壁伸展的速度,对于贴壁细胞的生长也是重要因素之一,传代细胞贴壁伸展的越快,细胞进入生长期的时间也就约早,这样有利于细胞的生长。除了细胞与支持物表面的贴附之外,细胞与细胞之间的粘附是最重要的过程之一。细胞间的连接有三种类型:封闭连接,通信连接和贴壁连接。封闭连接或者密封连接可以通过阻止分子从一侧渗漏到另一侧的方式将细胞密封在上皮细胞层内。通信连接介导着两个相互影响的细胞间的化学或电信号的传递。贴壁连接,是最有意义的一个,机械地将细胞贴附到与它们相邻的细胞或胞外基质上去。贴壁连接共有四种不同的类型:包括细胞与细胞之间的粘附连接、细胞与基质之间的粘附连接、细胞桥粒、以及半桥粒。贴壁连接常常形成一个连续的粘附带。细胞的贴壁连接是依靠细胞内、细胞膜、以及细胞基质层一系列蛋白共同完成。细胞内和细胞膜上与细胞贴壁连接有关的蛋白包括连环蛋白 (Catenins)、钙离子依赖性粘附素(cadherins)、选择素(selectins)等,这些蛋白功能的实现大多依赖于钙离子的存在。细胞基质在细胞贴壁连接中占有重要作用,它由两大类主要的胞外大分子组成,包括糖胺聚糖和纤维蛋白。纤维蛋白按功能分为两类,结构蛋白(例如,胶原和弹性蛋白)和粘连蛋白(例如纤粘连蛋白和层粘连蛋白)。胶原是体内胞外基质中的主要蛋白质,依靠粘连蛋的介导,细胞紧密地粘附在胶原结构上。细胞贴壁连接中另一类重要的蛋白是整合素,它们是动物细胞用于结合到胞外基质中去的最主要的受体。细胞粘附是一个多步骤的过程,包括最初细胞与表面的接触,细胞在表面的伸展,以及细胞的分化或生长。贴附涉及到跨膜粘附受体(例如钙粘素,整合素和神经细胞粘附因子)和吸附的粘附蛋白(如纤粘连蛋白fibronectin, 玻璃粘连蛋白vitronectin, 层粘连蛋白laminin)之间键的形成。在细胞粘附过程中,钙离子和镁离子是许多粘附蛋白的辅因子。因此,降低培养基中钙离子的浓度可以减弱细胞的粘附。
在细胞的低血清培养过程中,由于降低了使用血清含量,从而降低了血清中有利于细胞贴壁性的物质,使得细胞贴壁性能的降低,从而导致细胞正常贴壁生长受到影响,这是细胞在低血清环境中培养的最为重要的影响因素。调整培养基中的营养成份并调整细胞培养的控制方式,可在低血清培养状态下,保证细胞的正常贴壁性能,实现细胞的低血清培养。
对于细胞的低血清培养,影响细胞贴壁性的另一个重要因素使用的细胞培养瓶的质量。在进行BHK21 细胞低血清培养研究中我们发现,使用过的旧瓶子培养BHK21 细胞时细胞更容易发生脱落,而使用新瓶子进行培养时细胞能良好生长。我们将BHK21 细胞使用3%含量血清的 MD611进行细胞传代培养,不同时间进行细胞培养效果的比较观察,细胞培养照片如下。
使用旧瓶子培养BHK21 细胞,与新瓶子比较,在接种细胞后,新瓶子的细胞贴壁和伸展的更快,培养24 小时,新瓶子细胞明细增殖,但就瓶子较多的细胞依然是未完全伸展的椭圆形细胞;培养48 小时后,新瓶子细胞生长为较为致密的单层,而使用旧瓶子培养的细胞,细胞已经出现收缩脱落;继续培养至72 小时,使用新瓶子培养的BHK21 细胞,细胞只是出现细胞间间隙加大,但没有园缩脱落现象。
为了验证细胞瓶对细胞贴壁性能的影响,我们又用不同的细胞系293 细胞进行了相同的比较试验,细胞培养结果见下图。使用老的细胞瓶培养293 细胞,细胞成团而分布不均匀,细胞没有良好伸展生长;不同的试验结果出现在使用新的细胞瓶培养,细胞分布均匀而其伸展生长良好。该试验结果验证了老瓶子对细胞贴壁性能以及细胞维持性能的降低。