杨科1,2, 董娟2, 徐兰2, 周桢宁2, 王沁1, 丁小燕2
1 上海交通大学生命科学技术学院, 上海 200240
2 中国科学院上海生命科学研究院 生物化学与细胞生物学研究所, 上海 200031
摘 要: 胚胎干细胞在体外培养条件下能够维持自我更新, 并具有向多种细胞类型分化的能力, 因此被广泛用于研究
细胞分化的分子机理以及药物筛选。形成拟胚体(Embryoid body, EB)是胚胎干细胞分化常用的技术手段。为了便于今后利用EB 做进一步的药物筛选及分化研究, 严格规范了形成EB 的条件, 得到了分化状态均一性很高的EB。利用这一条件, 观察到在分化条件下长期培养(长达60 d)的EB 中仍有表达各项多能性指标的细胞集落。有关这一现象的进一步分析工作正在进行中。
关键词: 小鼠胚胎干细胞, 拟胚体, 多能性
Persistently Exist of ES-like Cell Population in Long-term
Cultured Embryoid Bodies
Ke Yang1,2, Juan Dong2, Lan Xu2, Zhenning Zhou2, Qin Wang1, and Xiaoyan Ding2
1 School of Life Sciences and Technology, Shanghai Jiaotong University, Shanghai 200240, China
2 Laboratory of Molecular and Cell Biology and Laboratory of Stem Cell Biology, Institute of Biochemistry and Cell Biology, Shanghai Institutes for
Biological Sciences, Chinese Academy of Sciences, Shanghai 200031, China
Abstract: Undifferentiated embryonic stem (ES) cells can be maintained in vitro if cultured in the presence of the cytokine leukaemia inhibitory factor (LIF). ES cells can also differentiate in vitro. A particularly efficient method for inducing ES cell differentiation is to culture ES cells as aggregates in the absence of LIF. Under these conditions they form structures known as embryoid bodies (EBs). However the current protocols for EB formation are still diverse. In order to facilitate further study, we carefully controlled the culture conditions for EB formation, and here we report an efficient protocol by which uniformly differentiated EBs were obtained, monitored by measuring the differentiation of beating cardiomyocytes. Furthermore, by using this protocol we observed in long-term cultured plating EBs (<60 days) there still exist cell colony with pluripotency. This observation raised a potential possibility that ES cells may keep pluripotent in a niche provided by differentiated cells.
Keywords: mouse embryonic stem cell, embryoid body, pluripotent
点此下载PDF全文:https://bbs.bbioo.com/thread-55061-1-1.html
胚胎干细胞(Embryonic stem cells, ES 细胞)是从胚胎早期内细胞团分离得到的多能干细胞。在一定培养条件下胚胎干细胞可以长期维持其多能性; 同时又可在一定条件下形成具有内、中、外三胚层结构的拟胚体(Embryoid bodies, EBs)。EB 被认为再现了胚胎从原肠运动前到早期原肠运动这段时间的发育过程, 而这个阶段的胚胎处于刚着床于子宫壁的阶段, 技术上很难获得。因此EB 被广泛用于研究胚层间相互诱导、器官空腔化形成等胚胎早期发育事件, 已成为干细胞研究领域不可或缺的技术手段。
虽然目前已经有很多利用EB 进行的研究, 但是我们发现不同的报道在形成EB 的方法上细节差异很大, 因此造成结果往往不尽相同。为了使以后的工作能够在重复性较好的稳定条件下进行, 我们在比较了现有的各种方案后, 得到了一个重复性相当高的形成拟胚体的实验方案。以出现博动心肌为指标, 用该方案形成的拟胚体出现博动心肌比例达 90%, 而且非常可重复。此外, 我们发现长时间在分化条件下培养拟胚体(60 d 以上), 其中仍然存在部分细胞群落, 其各项多能性指标为阳性。这一现象提示拟胚体有可能在细胞分化的同时为部分干细胞保持多能性提供了适宜的微环境。对于这一现象的进一步研究正在进行中。
1 材料与方法
1.1 材料
1.1.1 小鼠胚胎干细胞系
R1、E14 均购自ATCC。
1.1.2 细胞培养液
完全培养液: DMEM(GIBCO 12430), 15% FBS (BIOCHROM S0615), 0.1 mmol/L NEAA(GIBCO 11140- 050), 2 mmol/L L-glu(GIBCO 25030), 0.1 mmol/L β-mercaptoethanol(GIBCO 21985), 1000 u/mL LIF (CHEMICON ESG1107)。分化培养液: 与完全培养液相同但不加LIF。
1.1.3 细胞相关试剂
PBS (GIBCO 14190), 0.25% Trypsin-EDTA (GIBCO 25200), DMSO (SIGMA), Mitomycin C (SIGMA M0503-2MG), 0.2% Gelatin (Sigma)。
1.1.4 免疫染色抗体
一抗: Oct-4 (Chemicon AB3209), Anti-mouse Nanog (RD AF2729), SSEA-1 (RD MAB2155), SOX2 (RD MAB2018)。二抗: 相应二抗均购自Jackson 公司。
1.1.5 RT-PCR 相关试剂和序列
Trizol (MRC TR118), RT 试剂盒 (Revert Aid First Strand cDNA Synthesis kit: Fermentas K1622)。关键PCR 引物(5′-3′):
oct4: ggcgttctctttggaaaggtgttc, ctcgaaccacatccttctct, 30cycles;
nanog: aagtacctcagcctccagcagatg, agaaagtcctcccc gaagttatgg, 30cycles;
sox2: cgaccggcggcaaccagaagaaca, gccggcgcccaccccaacc, 30cycles;
rex1: cgtgtaacatacaccatccg, gaaatcctcttccagaatgg,35 cycles;
b-actin: ggtgggaatgggtcagaagg, aggaagaggatgcggcagtg, 19cycles。
1.2 方法
1.2.1 小鼠胚胎干细胞培养
小鼠胚胎干细胞培养和饲养层细胞的制备均参照ATCC®的方法步骤以及Nagy 等的文献[1]。R1 或 E14 小鼠胚胎干细胞用完全培养液培养在铺有明胶和饲养层的平皿上。2~3 d 后视克隆的大小和密度传代。饲养层细胞用丝裂霉素处理3 h 后冻存或直接使用。
1.2.2 饲养层的去除从冻存状态复苏小鼠胚胎干细胞, 在饲养层上培养2 d 左右。然后用胰酶消化下来, 传代(1:3~1:5) 至只铺有明胶的器皿上, 完全培养液培养18~36 h, 即可去除饲养层细胞的干扰。
1.2.3 EB 的制备将已经去除了饲养层的未分化的小鼠胚胎干细胞用胰酶消化, 计数, 用分化培养液稀释至大约 10~15 万个细胞/毫升的浓度, 进行悬滴。以20 μL 一滴, 将每滴悬液均匀的滴至平皿的上盖内表面。注意悬滴间距不宜太近或太远。滴满后的上盖迅速扣至已经事先加入少量PBS 的下盖上。随后小心放置培养箱中。48 h 后, 在每一个悬滴液体中均可以用肉眼看见一个白色颗粒状物体, 此即为拟胚体。用微量加样器可以小心地将拟胚体吸出, 进行随后的实验。
1.2.4 免疫组化染色
具体详细步骤参见各抗体说明书。简要步骤如下: 4%多聚甲醛固定细胞2 h, 封闭液处理0.5 h, 一抗4oC过夜, 二抗1 h。最后DAPI 染色10~15 min, 封片。各个步骤间用漂洗液洗3 次, 每次5 min。
1.2.5 RT-PCR
用TRIZOL 裂解细胞后提取总RNA, 具体操作参照TRIZOL 试剂说明书, 终样品测定OD260/280 确定RNA 质量。RT 反应总体系20 μL, RNA 样品各1 μg,反应条件参见试剂盒。终产物20 μL 的cDNA 于−20oC保存。PCR 反应总体系20 μL, cDNA 用量为1 μL。
2 结果
2.1 形成状态均一的拟胚体
小鼠胚胎干细胞形成的拟胚体模拟了胚胎体内的三胚层分化, 在体外贴壁培养条件下可观察到各种类型细胞的自发分化[2]。同时, 它也可以被不同的药物处理, 从而改变细胞的分化比例, 因此形成拟胚体是广泛用于胚胎干细胞分化研究的手段[3]。但是从目前的报道来看, 不同实验室的拟胚体细胞的分化在细胞类型和百分比上差别相当大[4]。为了使后续的研究工作在一个具有较好重复性的可靠条件下进行, 我们首先比较了各种有可能影响拟胚体形成的条件, 以规范制备拟胚体的实验步骤。
2.1.1 饲养层细胞对拟胚体的影响
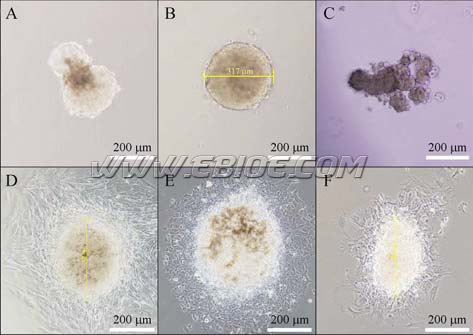
由于小鼠胚胎干细胞通常培养在饲养层细胞上, 胰酶消化胚胎干细胞时往往带有饲养层细胞, 而目前一般报道在形成拟胚体时不严格要求去除饲养层细胞。为了规范我们的实验条件我们首先比较了去除和不去除饲养层细胞所得到的拟胚体在形态上的差别。将胰酶消化后所得的细胞以10 万个/mL 的浓度直接悬滴, 得到的拟胚体有将近50%呈现出周缘毛糙, 聚集松散, 呈非典型的圆型形态 (图1A); 而通过一轮传代法去除饲养层细胞后以相同条件悬滴得到的拟胚体(见材料和方法)周缘光滑, 聚集紧密, 为正圆形态, 易于计算直径(图1B)。将得到的拟胚体进一步贴壁培养观察细胞分化, 可以看到混合细胞所形成的拟胚体周边有大量成纤维状细胞贴壁并迁移出来(图1D), 而去除了饲养层细胞的拟胚体周边贴壁迁移的细胞呈上皮细胞样, 形态均一(图1E)。我们还将未用丝裂霉素处理过的饲养层细胞以相同条件进行悬滴, 发现细胞也能形成松散的类似拟胚体的细胞聚集(图1C), 将其贴壁后观察同样有细胞贴壁并向外迁移(图1F), 细胞的形态与混合细胞所形成的拟胚体周边的细胞相似(比较图1D 与F), 提示我们在混合细胞形成的拟胚体体外贴壁培养时, 向外迁移的细胞有可能是其中的饲养层细胞, 而这些细胞在很大程度上会干扰我们的观察, 也有可能影响胚胎干细胞的分化。因此, 我们认为在制备拟胚体时必须去除饲养层细胞, 而我们采用的一轮传代法与其他方法相比较, 具有操作简单、重复性好和高效的特点。所以在以后的实验中, 我们均采用一轮传代法制备拟胚体。
图1 饲养层细胞对形成拟胚体的影响
Fig. 1 Feeder cells interfere with the formation of EBs
2.1.2 悬滴细胞浓度对拟胚体的影响
悬滴法形成拟胚体相对于悬浮法最大的优势, 就在于悬滴法能够形成大小均一的拟胚体, 从而可以近似认为它们之间内部细胞结构一致, 处于统一的分化阶段, 便于以后的实验研究。而初始的细胞浓度是后来影响拟胚体的大小的一个关键因素。为了探讨每一悬滴中细胞数量多少对形成的拟胚体以及今后细胞分化的影响, 我们比较了用不同细胞数目形成拟胚体的效率以及相应的细胞分化状况。分别以浓度为5、10、20、30、40 万个细胞/mL 进行悬滴实验, 我们发现悬滴2 d 后所得到的EB 直径与悬滴浓度成正比关系。但是我们注意到, 在以大约2000 个细胞每滴的条件下, 即悬滴细胞浓度大致为10 万个细胞/mL 时, 所得到拟胚体直径均一(300 μm 左右), 相对于其他细胞浓度效率最高, 可达95%以上。
拟胚体贴壁培养6 d 后, 可以观察到有自发的心肌分化, 表现为有节律的搏动[5]。出现自发心肌分化的拟胚体的百分比在不同的报道中相差很大。我们的实验表明, 在前述条件下, 即悬滴时细胞浓度为10 万个细胞/mL 时, 出现心肌分化(以观察到搏动的心肌为标准)的EB 可达到90%以上, 多次实验均重复了这一结果, 因此我们确定10 万个细胞/mL 为我们的实验条件, 该条件下, 我们制备的拟胚体具有相当高的均一性, 对下一步利用拟胚体进行细胞分化以及其他研究奠定了可靠的基础。
2.2 长期培养的拟胚体中存在多能性细胞
2.2.1 分化培养基中长期培养的拟胚体中有oct4 阳性细胞存在
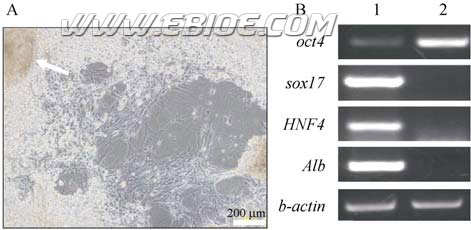
胚胎干细胞在悬滴以及在后续的贴壁培养时所使用的培养基中没有LIF, 也就是一般认为细胞进入开始分化的程序。我们用上述条件形成拟胚体, 然后观察各种类型细胞的分化并得到了稳定的可重复的结果。随着培养时间的推移可以观察到从拟胚体向外迁移的细胞分化为神经、肌肉、心肌、脂肪等类型的细胞。但是我们注意到如果将拟胚体在不含LIF 的分化培养液中长期培养, 虽然不断有细胞向外迁移分化, 但伴随着各种形态的细胞的出现, 原本的拟胚体始终维持集落的状态(图2A 左上角箭头所指)。同时, 我们在用RT-PCR 分析不同的分化标志性基因表达时, 发现即使拟胚体在分化培养条件下长达 60 d, 连肝细胞分化标志基因Alb 都已经大量表达时, 仍有oct4 基因表达(图2 B)。这一现象提示我们在这一细胞群体中有可能仍存在多能性细胞。
图2 长期培养的拟胚体中有oct4 阳性细胞
Fig. 2 Oct4 positive cells in long-term culture EBs
A: the morphology of 48-day-old plating EBs; B: RT-PCR analysis of oct4 expression in 60 days plating EBs (lane 1) and normal ES (lane 2)
2.2.2 长期培养的拟胚体中存在多能性细胞
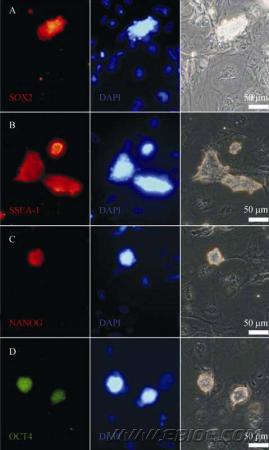
为了了解EB 长期培养在分化条件下的拟胚体细胞中是否仍然有可能存在一些多能性细胞, 我们用免疫组化检验了在分化培养基中培养长达30 d 的拟胚体。结果表明在原本是拟胚体的细胞集落中间, 的确存在表达多能性标志如ssea-1、sox2 以及oct4 的细胞(图3)。我们对此现象进行了多次不同批次的实验, 发现在我们实验的样品中, 有至少30%的细胞群落中有表达多能性标志的细胞, 观察发现这些阳性细胞群落多集中在拟胚体(图3 I)或是细胞聚集区域的中央(图3 C,F)。
图3 长期培养的拟胚体中存在多能性细胞
Fig. 3 Pluripotent cells in long-term culture EBs
2.2.3 长期培养的拟胚体中多能性细胞能传代形成克隆
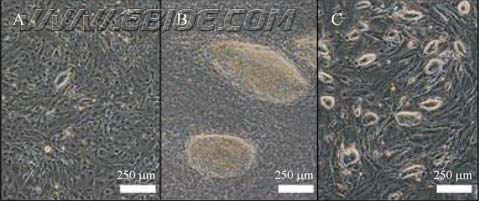
如果在长期分化条件下培养的拟胚体细胞中确实存在多能性细胞的话, 除了用上述多能性指标检验外, 它们消化传代后还应该能够形成克隆。为了进一步检验这一假设, 我们将拟胚体贴壁设定为0 d, 将贴壁15 d 的拟胚体用胰酶消化下来, 再将细胞悬液铺在明胶上, 继续用分化培养液培养。观察发现, 最初的2~3 d 中, 大部分细胞为成纤维状细胞, 偶尔见一两个形态不很明确的小克隆(图5A)。随后这些小克隆越长越大, 8~9 d 后成为形态扁平状的大克隆 (图4B)。
图4 长期培养的拟胚体传代后仍能形成克隆
Fig. 4 Capable of forming clones after passage of long-term culture EBs
(A) 3 days after passage of 15-day-old EBs; (B) 8 days after passage of 15-day-old EBs; (C) 2 days on feeder cells after passage of cells in panel B
如果将这些较大的克隆用胰酶消化后铺于饲养层细胞上用分化培养基培养, 2 d 后又可观察到大量典型的小鼠胚胎干细胞克隆(图4C); 如果将图 5B 中较大的克隆用胰酶消化后铺于无饲养层的明胶上用分化培养基培养, 同样可以观察到明显的克隆形成。我们用多能性标志基因的抗体染色, 证明这些克隆确实是由多能性细胞组成(图5)。除了贴壁 15 d 的拟胚体以外, 我们用贴壁5 d、10 d、20 d 的拟胚体都得到了相同的实验结果。
Fig.5 Pluripotent cells after 2 passages of long-term culture EBs
2.2.4 长期培养的拟胚体中的多能性细胞仍然能形成拟胚体
我们发现将用上述方法得到的这些类似胚胎干细胞经过一步传代法去除饲养层后, 再进行悬滴仍可形成EB。我们将所得到的EB 贴壁, 用RT-PCR 连续观察了部分基因在EB 贴壁后0 d、2 d、4 d、6 d、8 d 的表达(图7)。我们发现, 最初4 个最基本的多能性指标相关的基因(oct4、nanog、sox2 和rex1)都正常表达, 随着时间的推移其表达逐渐减低, 而分化基因的表达逐渐增加(foxa2)。brachyury(T)基因表达峰值出现在3~5 d。在8 d 后, 多能性相关基因仍有微弱的不同程度的表达, 而不是完全消失。该表达谱与正常小鼠胚胎干细胞形成拟胚体的基因表达谱相似[6]。
3 讨论
拟胚体是广泛用于干细胞研究的一种途径, 而目前关于形成拟胚体方法的报道彼此相差很大, 这对于后面的分化实验是相当不利的。一般的文献在形成EB 的时候并没有强调去除饲养层细胞。但是考虑到饲养层细胞可以分泌释放白血病抑制因子 (LIF), 和其他一些促胚胎干细胞保持未分化状态的因子, 因此普遍认为在胚胎干细胞的分化模型中, 饲养层细胞的存在具有负作用。同时在悬滴细胞聚集的过程中, Weitzer G 等[7]认为饲养层细胞还可能竞争胚胎干细胞细胞间的相互作用, 对胚胎干细胞细胞间的交流过程起到隔离的影响。因此在拟胚体的形成过程中应该尽量去除掉饲养层细胞。我们的实验结果表明, 如果不去除饲养层细胞则对会对拟胚体以后的形态观察造成很大的影响。由于在悬浮法培养拟胚体过程中, 大部分残留的饲养层细胞会首先沉于皿底而贴壁, 少量未贴壁的饲养层细胞再在皿中和胚胎干细胞接触聚集的几率将远远小于在 20 μL 悬滴中两者的接触几率。因此在悬浮法形成 EB 的过程中, 饲养层的影响将远没有在悬滴法形成 EB 过程中那么重要。所以我们在用悬滴法成EB 的过程中一定要尽可能的将饲养层细胞去除干净。经过我们大量的实验证实, 用一步传代法去除饲养层细胞时, 少数分化的ES 以及微量存活的饲养层细胞对后续实验影响基本很小, 在形态学和各项分化指标上均无显著影响。当然如果想要把饲养层细胞完全去除干净, 则还需要无饲养层培养2~3 代。此时在培养液上不能用未知因素较多的血清而需要用昂贵的血清替代物, 同时需要添加其他生长因子如 BMP4。
在悬滴法形成拟胚体的过程中, 我们认为除了需要去除饲养层细胞外, 初始的悬滴细胞浓度也是一个关键的因素。我们严格的比较各种条件后, 发现以10 万个细胞/mL 悬滴2 d 后再贴壁的方法最理想。用该条件得到的拟胚体表现为形态均一, 我们在不同的细胞系中多次重复, 得到了相同的结果, 因此这是一个有用的方法。虽然Dang SM 等[8]认为, 不同大小的EB 在经过一段时间培养后, 都能达到一定的分化程度, 但是我们认为悬滴时仍然需要遵从我们所述的条件。原因之一是当以大于这个浓度悬滴时, 我们发现在2 d 后, 悬滴培液明显变黄, 而这是由于其内pH 值的改变而造成的, 往往也指示了培液中的养分不足, 这对EB 的早期形成是不利的。原因之二, 当以小于这个浓度悬滴时, 虽然是一些文献报道[4]所推荐, 但是我们认为在胰酶消化的过程中必然伴随着部分细胞的死亡, 细胞计数难免会将这些细胞计算进去。同时悬滴初期细胞过少就需要更多的悬滴时间(大于2 d)来形成较为成熟的EB。综上所述, 我们认为10 万个细胞/mL 悬滴2 d 是最优化的实验条件。
一般认为胚胎干细胞在分化条件下培养, 可自发分化为各种类型的细胞。即一旦撤掉LIF, 小鼠胚胎干细胞均会自发分化, 逐渐丢失多能性[9]。拟胚体培养则是最常用的研究细胞分化的手段。但是在我们的实验中,我们发现即使将拟胚体在分化条件下长期培养, 仍然可以在其中观察到存在oct4、ssea1、 nanog 和sox2 阳性的细胞。我们的实验表明至少在大于60 d 后仍然可观察到有少量这样的细胞存在。目前对于EB 分化阶段oct4 的表达下降趋势尚有争议[5]。Choi[10]和Cartwright[6]的文献中虽然所用ES 细胞系不同, 但是都用撤去LIF 再悬浮形成EB 的方法, 前者在6 周EB 用RT-PCR 观察到oct4 表达, 而后者5 d EB 中oct4 表达已经很微弱。考虑到一般做 RT-PCR提取的是所有细胞的mRNA, 而多能性指标阳性的细胞往往只占全部细胞的一小部分, 所以没有扩增出条带是可以理解的。这里我们用免疫荧光染色清楚的证明了在我们的悬滴再贴壁系统中这些阳性细胞的存在。目前我们还不清楚这些阳性的细胞是否是原先的胚胎干细胞一直维持下来的, 还是部分分化的细胞又逆转回来的, 对此相关的实验正在进行中。
Bendall SC 等[11]认为, 人类的胚胎干细胞可以自发分化出hdFs(Derived human ES cell fibroblast-like cells), 这种类似饲养层的细胞可以起到可以和人胚胎干细胞协同作用, 从而维持人胚胎干细胞的不分化。那么作为鼠源的胚胎干细胞是否也具有这样的能力, 即分化出某种类饲养层细胞从而维持自身的不分化?我们观察发现, 在将长时间培养的拟胚体消化后再培养时, 总是存在大量的类成纤维细胞, 随着我们用分化培养液将这群细胞不断地传代, 初期一两代, 还是能找到大量典型小鼠胚胎干细胞的克隆形态, 但是随着传代次数的上升, 原先大量存在的类成纤维细胞由于自身的增生能力远不如未分化的细胞, 逐渐减少。而随着这些类成纤维细胞的数量的减少, 在没有LIF 的情况下, 那些典型小鼠胚胎干细胞的克隆形态也逐渐丧失。这暗示着很有可能是小鼠胚胎干细胞在拟胚体中自身分化出的这些类成纤维细胞的存在, 维持了其部分群体细胞的多能性。对于这一现象的进一步的机制研究还在进行中。