杨晓宁1 田宗文1Δ 黄焕斌2 刘维新1 陈锡昌1
(1武汉大学医学院人体解剖学与组织胚胎学系,武汉 430071;2孝感市中心医院外科)
心肌细胞培养作为一种体外实验研究模型,可以更方便地从细胞和分子水平研究心血管疾病的发病机制,成为心血管疾病研究的一项主要手段和基本技术。如何使心肌细胞培养的方法更为简单并且使分离的心肌细胞达到理想的存活率和纯度,是体外培养心肌细胞模型的关键问题。我们在本实验室多年新生大鼠心肌细胞培养的经验和方法的基础上加以改进,获得了简单并且稳定、可靠的心肌细胞培养的方法。
1 材料和方法
1.1 实验动物 1~3d龄Wistar大鼠(武汉大学实验动物中心提供),雌雄不拘。
1.2 实验试剂 胰蛋白酶和胶原酶(Gibco);谷氨酰胺(武汉天源生物技术有限公司);新生牛血清(Gibco);DMEM 干粉培养基(Hyclone)。
1.3 培养方法 取1~3d龄Wistar大鼠15~18只,无菌条件下剪取心脏,仔细剥离心房及大血管组织,然后于预冷的 D-hank's液中漂洗3次。将心肌组织放于50ml离心管的侧壁上,倾斜离心管,吸净管底液体,用眼科小弯剪将组织剪成约0.5mm3碎块。加入5倍体积的0.08%胰蛋白酶溶液,反复吹打后置37℃恒温摇床(190r/min)消化3~5min,静置, 待自然沉降后弃去上清液。剩余沉淀再加入约5倍体积 0.08%胰蛋白酶及0.1%胶原酶混合液,反复吹打后置37℃ 恒温摇床(190r/min)消化5~ 8min,静置后将上清液移入 10ml离心管中,反复吹打至无细胞团块后用2倍体积含20% 新生牛血清的DMEM 培养液终止消化。剩余沉淀用同样条件及方法继续消化,一般经3次消化即可将组织消化完毕。各次消化产物以1000r/min离心10min,弃去上清液后将细胞重悬于含20%新生牛血清的DMEM 培养液,然后接种于 90mm培养皿。37℃、5%CO2 培养箱中孵育1h后,轻轻吸出细胞悬液,以105/ml的密度接种于60mm培养皿(皿底铺多聚赖氨酸包被过的玻片),置37℃、5%CO2 培养箱中培养。 8~12h后更换培养液,并用2μg/ml的丝裂霉素C维持48h。以后每2~3d换液1次。
1.4 细胞存活率测定 接种前将2%台盼蓝溶液与细胞悬液混合均匀(2:1),滴入细胞计数板,2min后于倒置相差显微镜下计数,未着色的为活细胞,呈蓝色的为死细胞,计算细胞存活率。
1.5 心肌细胞形态学观察 倒置相差显微镜下动态观察心肌细胞形态学变化并摄像。
1.6 心肌细胞纯度鉴定 培养第3天,无菌条件下取出细胞爬片,用含0.1%TritonX-100的4%多聚甲醛固定10min,用 0.01mol/LPBS漂洗3次后分别加入以1:100、1:50稀释的小鼠抗大鼠心肌特异性MHCα/β、TnI抗体(福州迈新公司)于4℃孵育过夜。然后分别用FITC标记的山羊抗小鼠IgG及罗丹明标记的山羊抗小鼠IgG抗体(北京中山生物技术有限公司)孵育1h。随机选取20个视野于荧光显微镜下观察,免疫荧光染色阳性细胞为心肌细胞,计数并摄像。同一视野于普通光条件下计数细胞总数,计算心肌细胞纯度。
2 结果
2.1 细胞存活率测定 台盼蓝染色观察仅5%细胞着色,细胞存活率达95%以上。
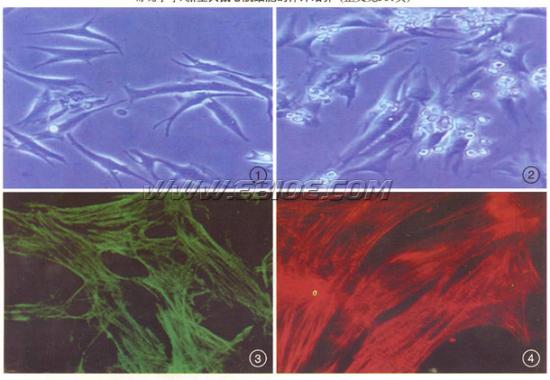
2.2 心肌细胞形态学观察 刚接种的心肌细胞尚未贴壁,呈圆形,悬浮于培养液中。8~12h换培养液时,部分心肌细胞已贴壁生长,并出现自发性搏动,搏动频率较慢,有的每分钟仅数次。24h后观察细胞已全部贴壁,贴壁后为梭形,菱形或多角形(图1),90%开始搏动。继而细胞逐渐在皿底表面铺展,并伸出伪足,形成不规则的星形并相互接触交织成网,在培养第48h可形成呈放射状排列的细胞簇(图2),其搏动已同步化,每分钟120次左右。培养90d仍可见到成团搏动的心肌细胞。
2.3 心肌细胞纯度鉴定 分别用心肌特异性MHCα/β、TnI抗体免疫荧光检测均证明心肌细胞纯度达95%以上,并可见明显的心肌特异性横纹结构(图3,图4)。
图版说明(图见插4)
图1 24h后,贴壁的心肌细胞呈梭形、菱形或多角形,×200.
图2 48h后,心肌细胞形成呈放射状排列的细胞簇,×200.
图3 抗心肌特异性MHC抗体免疫荧光染色,二抗为FITC标记的山羊抗小鼠IgG,×400.
图4 抗心肌特异性TnI抗体免疫荧光染色,二抗为罗丹明标记的山羊抗小鼠IgG,×400.
3 讨论
3.1 消化过程是影响心肌细胞存活率的重要因素 胰蛋白酶可分解组织间质的蛋白成分,但对肌细胞膜蛋白亦起较强的破坏作用[1],故对其作用时间和浓度的要求较为严格。而每次实验都可能有细微差别,所以应结合肉眼观察消化情况及时终止消化,不宜固定精确的消化时间。胶原酶可消化细胞间质的胶原纤维以释放细胞[1],作用较缓和,对细胞损伤较小。本实验室的多年经验认为单一使用胰蛋白酶消化对细胞损伤大,联合使用胶原酶将胶原纤维充分消化后利于离心时细胞沉淀,提高心肌细胞存活率,细胞贴壁早,搏动出现亦早。第一次消化时间以3~5min为宜,主要是去除一些血细胞、从组织边缘消化下来的坏死心肌细胞及其细胞碎屑,时间不易太长,否则会丢弃一些已消化下来的心肌细胞。终止消化后的消化产物应立即离心后重悬于培养液以使受损的细胞尽早恢复。消化过程中我们强调反复吹打,因为吹打能使酶与组织充分均匀接触,减少消化次数和时间,提高细胞存活率。每次消化产物并不彻底,需反复吹打使心肌细胞呈单个分散状态再终止消化。吹打不充分细胞团块占5%以上会大大降低心肌细胞的收获率,并且从团块中爬出来的成纤维细胞影响心肌细胞的生长和纯度。
3.2 尽可能多的去除成纤维细胞是提高心肌细胞纯度的关键 成纤维细胞较心肌细胞更容易贴壁,采用差速贴壁的方法可去除大部分成纤维细胞。差速贴壁时间以1h为最佳,与大部分文献报道60~90min[2,3]一致。另外,我们于培养8~ 12h后换液将培养液中的细胞团块去掉并加入有丝分裂抑制剂丝裂霉素C(抑制成纤维细胞的DNA和蛋白合成)以尽量减少自细胞团块中爬出来的成纤维细胞并抑制其生长,但操作时需小心谨慎,避免刚刚贴壁的心肌细胞随换液而被丢弃。加入溴脱氧尿苷[4]亦可达到抑制其增生的目的。
3.3 培养液是维持细胞生存的基本条件 心肌细胞在偏酸性环境中(pH值7.0~7.2)更利于生长,培养液储存后pH 值逐渐升高,最好现配现用。如培养液储存2周以上还应重新加入原量的谷氨酰胺,因为细胞需要谷氨酰胺合成核酸和蛋白质,而谷氨酰胺在溶液中易分解。抗生素的药效浓度与毒效浓度接近,对细胞可造成损害,实验中注意无菌操作可有效预防污染,故培养液中不加抗生素。如经费条件许可,前48h 可用胎牛血清培养,因胎牛血清较新生牛血清含有更多的生长调节因子和营养成分,初次分离的心肌细胞在此环境中生长更好。
参考文献
1 薛庆善.体外培养的原理与技术.北京:科学出版社,2001. 618-636.
2 SuzukiT,OhtaM,HoshiH.Serum-freechemicallydefinedmediumtoevaluatethedirecteffectsofgrowthfactorsandinhibitorson proliferationandfunctionofneonatalratcardiacmuscleinculture. InvitroCellDevBiol,1989,25(7):601-606.
3BesS,RousselP,LaubrietA,etal.Influenceofdeephypothermiaonthetoleranceoftheisolatedcardiomyocytetoischemia- reperfusion. JMolCellCardiol,2001,33(11):1973-1988.
4 SimpsonP,SavionS.Differentiationofratmyocytesinsinglecell cultureswithandwithoutproliferatingnonmyocardialcells.Circ Res,1982,50(1):101-116.