RNA干扰(RNA interference ,RNAi) 现象是一种进化上保守的抵御转基因或外来病毒侵犯的防御机制。将与靶基因的转录产物mRNA 存在同源互补序列的双链RNA(double strand RNA ,dsRNA) 导入细胞后,能特异性地降解该mRNA ,从而产生相应的功能表型缺失,这一过程属于转录后基因沉默机制( posttranscriptional gene siliencing , PTGS) 范畴。RNAi 广泛存在于生物界,从低等原核生物,到植物,真菌,无脊椎动物,甚至近来在哺乳动物中也发现了此种现象,只是机制也更为复杂。
一.RNAi的发现
早在1990 年进行转基因植物有关研究时偶然发现,将全长或部分基因导入植物细胞后某些内源性基因不能表达,但这些基因的转录并无任何影响,并将这种现象称为基因转录后沉默(posttranscriptional gene silencing ,PTGS) . 1996 年在脉孢菌属(Neurospora) 中发现了相似现象,只不过将这种现象命名为基因表达的阻抑作用(quelling) . 首次发现dsRNA 能够导致基因沉默的线索来源于线虫Caenorhabditis elegans 的研究。1995年康乃尔大学的研究人员Guo 和Kemphues 尝试用反义RNA 去阻断par-1 基因的表达以探讨该基因的功能,结果反义RNA 的确能够阻断par21基因的表达,但是奇怪的是,注入正义链RNA 作为对照,也同样阻断了基因的表达。这个奇怪的现象直到3年后才被解开——华盛顿卡耐基研究院的Andrew Fire 和马萨诸塞大学癌症中心的Craig Mello 首次将双链dsRNA ——正义链和反义链的混合物注入线虫,结果诱发了比单独注射正义链或者反义链都要强得多的基因沉默。实际上每个细胞只要很少几个分子的双链RNA 已经足够完全阻断同源基因的表达。后来的实验表明在线虫中注入双链RNA 不单可以阻断整个线虫的同源基因表达,还会导致其第一代子代的同源基因沉默。他们将这种现象称为RNA 干扰。
过去认为, 哺乳动物细胞中不存在RNAi 现象,因为较长的dsRNA 在哺乳动物细胞中能诱导IFN(干扰素) 生成,并激活STAT 途径参与的PKR(dsRNA 依赖性激酶) 的转录,同时dsRNA 本身与PKR 结合也能令其激活,继而磷酸化翻译起始因子eIF2a 使之失活,导致非特异性的蛋白质合成障碍;另一方面,dsRNA 又能诱导细胞产生多种抗病毒蛋白的2′,5′腺苷合成酶,生成 2′,5′腺苷酸,激活非特异性的RNA 酶L ,发生非特异性的RNA 降解效应。现在发现, 只要dsRNA 短于30bp ,就不会促发干扰素效应,同时又能特异性地降解mRNA ,引起基因沉默,说明dsRNA 在哺乳动物细胞中也能发挥一定作用,为以后的基因治疗等RNAi 应用领域提供了新的研究方向。
二.RNAi的作用机制
近年来研究发现,干扰性小RNA( small interfering RNA ,或short interfering RNAs , siRNA) 是RNA 干扰作用(RNAi) 赖以发生的重要中间效应分子. siRNA 是一类长约21~25 个核苷酸( nt ) 的特殊双链RNA(dsRNA) 分子,具有特征性结构,即siRNA 的序列与所作用的靶mRNA 序列具有同源性; siRNA 两条单链末端为5′端磷酸和3′端羟基. 此外,每条单链的3′端均有2~3 个突出的非配对的碱基RNAi 的主要过程是,dsRNA 被核酸酶切割成21~25 nt 的干扰性小RNA ( siRNA) ,由siRNA 介导识别并靶向切割同源性靶mRNA 分子. 细胞中dsRNA的形成是RNAi 的第一步. 细胞中dsRNA 可通过多种途径形成,如基因组中DNA 反向重复序列的转录产物;同时转录反义和正义RNA ;病毒RNA 复制中间体;以及以细胞中单链RNA 为模板由细胞或病毒的RNA 依赖RNA 聚合酶(RdRp) 催化合成dsRNA等. 在线虫( C. elegans) 可以直接注射dsRNA 或把线虫浸泡在含dsRNA 溶液中等方式引入外源dsRNA ,还可以通过喂养表达正义和反义RNA 的细菌获得dsRNA.
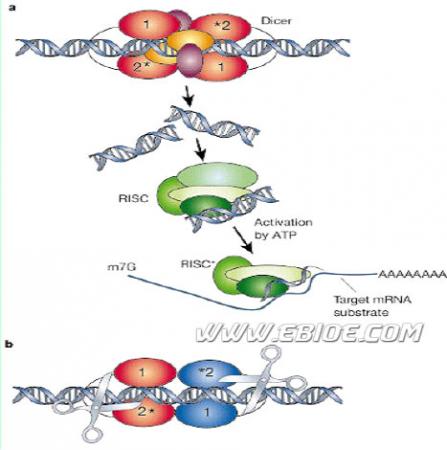
现已初步阐明RNAi 的作用机制. RNAi 的第一步是,dsRNA 在内切核酸酶(一种具有RNase Ⅲ样活性的核酸酶) 作用下加工裂解形成21~25 nt 的由正义和反义序列组成的干扰性小dsRNA ,即siRNA.果蝇中RNase III 样核酸酶称为Dicer. Dicer 含有解旋酶(helicase) 活性以及dsRNA 结合域和PAZ 结构域. 已发现在Arabidopsis , C. elegans , Schizosaccharomyces pombe 以及哺乳动物中也存在Dicer 同类物. RNAi 的第二步是,由siRNA 中的反义链指导形成一种核蛋白体,该核蛋白体称为RNA 诱导的沉默复合体( RNA induced silencing complex , RISC) , 由RISC 介导切割靶mRNA 分子中与siRNA 反义链互补的区域,从而达到干扰基因表达作用. RISC 由多种蛋白成分组成,包括内切核酸酶、外切核酸酶、解旋酶和同源RNA 链搜索活性等. 线虫C. elegans中的MUT7(一种RNase D样蛋白) 可能是一种3′5′外切核酸酶. 此外, PAZPPiwi 蛋白家族成员可能是RISC中的构成组分,如Arabidposis 中的AGO1 ; N.Crassa 中的QDE; C. elegans 中的RDE1 等,以上这些蛋白与翻译因子eIF2C 同源.
引自 Gregory J.Hannon(2002) Nature,418,244-251
最新的研究进一步揭示,ATP 在siRNA 介导的RNAi 中具有重要作用. 较长dsRNA 向siRNA 的转变要有ATP 参与. siRNA 与蛋白因子形成一个无活性的约360 kD 的蛋白PRNA 复合体;随之, siRNA双链结构解旋并形成有活性的蛋白PRNA 复合体(RISC) ,此步具有ATP 依赖性. RISC 活性复合体对靶mRNA 的识别和切割作用,这一步可能不需ATP参与.
此外,ATP 使siRNA 5′端带上磷酸分子,且对siRNA 的功能具有重要作用. 上述过程中siRNA 双链结构解旋很可能是一种稳定的结构改变,因为siRNA 双链体与细胞裂解物、ATP 等孵育后再除去ATP 及其它辅助因子,含有siRNA 的活性复合体仍能识别和切割靶mRNA 分子
siRNA 可作为一种特殊引物,在RNA 依赖RNA聚合酶(RdRp) 作用下以靶mRNA 为模板合成dsRNA ,后者可被降解形成新的siRNA ;新生成的siRNA又可进入上述循环. 这种过程称为随机降解性多聚酶链反应(random degradative PCR) . 新生的dsRNA 反复合成和降解,不断产生新的siRNA ,从而使靶mRNA 渐进性减少,呈现基因沉默现象. RdRp 一般只对所表达的靶mRNA 发挥作用,这种在RNAi 过程中对靶mRNA 的特异性扩增作用有助于增强RNAi的特异性基因监视功能. 每个细胞只需要少量dsRNA 即能完全关闭相应基因表达,可见RNAi 过程具有生物催化反应的基本动力学特征.
miRNA 与siRNA 的区别:
(1) miRNA是单链的,而siRNA则是双链的;
(2) miRNA参与正常情况下生长发育基因调控,而siRNA不参与动物体的正常生长,只有在病毒或其它dsRNA诱导情况下才产生siRNA,作为miRNA的完善和补充;
(3) miRNA在转录后水平调节基因表达,推测在翻译水平也起作用,而siRNA为转录后水平调节基因表达调控;
(4) Dicer酶对两类RNA的加工过程,miRNA为不对称性,仅来自含茎-环结构RNA前体的一侧臂,剩余部分很快降解,而这种不对称性不存在于而siRNA加工过程中。
三,RNAi的应用前景
RNAi 技术中的相关问题主要涉及以下几点:
(1) dsRNA 序列的选择dsRNA 主要选自已知的cDNA 的开放阅读框架(ORF) 中的基因区域。为防止mRNA 调控蛋白对RISC 与靶RNA 结合的干扰,应避免选择包括:1) 起始密码子下游或终止密码的50~100 核苷酸位置以内的区域;2) 5′或3′端的非翻译区域;3) 内含子区域。此外,序列选择时也应避开多聚鸟苷酸序列区( ≥3 个) ,因为这样容易形成四聚体结构, 抑制RNAi 作用。选择与靶mRNA 上序列互补的21~23 个核苷酸长度的片段,以AA 开头为佳,因为此法能简化dsRNA 合成过程,降低成本,而且合成的dsRNA 能更好地抵抗RNA 酶的降解。另外,尽量使dsRNA 序列中的GC含量接近50 %(45 %~55 %最佳) ,高GC 含量能明显降低基因沉默的效应。选择前可以搜索BLAST数据库,保证无其他与靶基因同源的基因存在,避免引起对其他相似基因的沉默作用。并不是所有的mRNA 均对RNAi 敏感。为确保靶基因表达的有效抑制,最好同时合成两个或以上的针对同一基因的不同靶区域的dsRNA ;而且,标记dsRNA 正义链的3′端对RNAi 现象并没有影响,现有的实验尚未发现mRNA 的二级结构对RNAi 有任何显著的影响。目前,RNAi 技术主要以哺乳动物细胞为对象研究其基因的功能。但< 30bp 的dsRNA 在哺乳动物细胞中会引起干扰素样效应,导致非特异性反应。因而直接选用其下游的产物分子siRNA 来代替,达到基因研究的目的。
(2) dsRNA 的导入方法不同的生物体可以选择不同的方法。简单生物,如单细胞生物等,可选用电穿孔的方法; 较复杂生物可选用dsRNA 微注射入生殖细胞或早期胚胎,线虫也能采用肠道或假体腔注射的方法,与微注射相比,RNAi 效率上并无显著差别。还有浸泡法、工程菌喂养法、磷酸钙共沉淀法等。若使用的是化学法人工合成的siRNA(正义链和反义链) ,还要经过退火过程,以双链的形式导入靶细胞。有人提出了以质粒或病毒为载体,通过转导或转染途径,在细胞内以DNA 为模板,利用RNA 聚合酶Ⅲ,转录为siRNA(直接形成双链或通过回文序列折叠后形成发夹结构) ,也能产生较明显的RNAi 效应。最近,又有一种新的导入方法,就是借助高压水枪的外力将构建的质粒直接自小鼠的尾静脉注入体内,观察RNAi 在活体生物模型而不是培养细胞上的基因沉默效应 ,但观察到的siRNA 的半衰期较短,而且由于使用了高压的外力,过程较复杂,限制了其在人类疾病治疗方面的应用。而Pachuk 等则提出了肌注的方法,将针对IL-12 的siRNA 的质粒表达载体导入小鼠体内,得到的RNAi 效应更持久。
(3) 发夹样结构的siRNA实验证明,发夹样siRNA 能延长在细胞内的作用时间。此类结构可由具有回文序列的核苷酸链形成。但通常回文结构不易获得,也可用头碰头的对称序列来代替。转录发夹样siRNA 的模板必须与载体转录启动子紧密相连,而且尽可能有最短的多聚腺苷酸尾巴,这样才能诱导高效的RNAi 效应。Paddison 等提出类似的结构也可应用于长片段dsRNA (500bp 左右) ,而不会引起RNA 非特异性的降解。这为检测哺乳动物细胞中经过长期发育后的基因功能提供了新的途径。
RNAi 的应用领域及前景:RNAi 是一种高效的特异性强的基因阻断技术,近年来发展迅速,很快就成为功能基因组研究的有力工具。通过实验手段将dsRNA 分子导入细胞内, 特异性地降解细胞内与其序列同源的mRNA ,封闭内源性基因表达,从反向遗传的角度研究人类或其他生物基因组中未知基因的功能。早期就有人应用此项技术分离了果蝇胰岛素信号转导途径通路中的各种成分。近来也有实验报道通过RNAi 研究细胞内脂质平衡过程中涉及的各条途径。在这之前,曾利用反义RNA 与靶mRNA 序列互补的特性来抑制其表型的发生,但由于反义RNA对内源性表达的基因抑制作用较弱,往往会产生一些过渡表型,易造成对基因功能判断错误,目前已通过审批认为临床上具有治疗作用的仅有一种药物———Vitravene 。RNAi 技术与之相比,特异性更高,作用更迅速,副反应小,在有效地沉默靶基因的同时,对细胞本身的调控系统也没有影响。最近在人类体细胞里已经成功地对近20 种基因功能进行了“敲除”,尤其是因此而了解了人类空泡蛋白Tsg101 对HIV 在人体内增殖的作用,进一步深化了对HIV 的研究。Leonid 等以脊髓灰质炎病毒为模型,利用RNAi 来诱导细胞的胞内免疫,产生抗病毒效应,尤其是针对RNA 病毒。对于易突变的病毒,可设计多种靶向病毒基因保守序列的dsRNA ,减少它对dsRNA 的抵抗。Maen 等也应用RNAi 技术成功地阻断了MCF-7 乳腺癌细胞中一种异常表达的与细胞增殖分化相关的核转录因子基因Sp21 的功能。RNAi 技术的应用,不仅能大大推动人类后基因组计划(蛋白组学) 的发展,还有可能设计出RNAi 芯片,高通量地筛选药物靶基因,逐条检测人类基因组的表达抑制情况来明确基因的功能,并且它还将应用于基因治疗、新药开发、生物医学研究等领域,用RNAi 技术来抑制基因的异常表达,为治疗癌症、遗传病等疾病开辟了新的途径。
参考文献:
1.Gregory J.Hannon,(2002) Nature,418,244
2.陈颖朱明华(2003)中国生物工程杂志,23(3),39
3.陈忠斌,于乐成,王升启 (2002) 中国生物化学与分子生物学报 18 (5) :525
4.吴青(2003)中国生物工程杂志,23(1),92
5.张敏(2003)国外医学分子生物学分册,25(1),55
6.Rander ES et al. Nature, (2001); 409,860
7.B renda L et al. Nature, (2002); 411,428