1 RNA 的提取
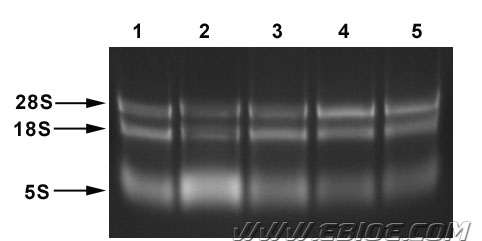
RNA 提取物的完整性是进行电泳的主要目的之一。在有EB 存在时,完整未降解的RNA制品电泳图谱应可清晰看到18S rRNA、28S rRNA 两条带,也应当能看到一条由tRNA、5.8S rRNA 和5S rRNA 组成的、较模糊迁移较快的条带,且28S rRNA 条带亮度应为18S rRNA的1.5-2 倍。
附图:本公司RISOTM RNA 抽提试剂盒与其他公司产品的比较 Line 1、2、3:国内某3 家公司RNA 抽提试剂;Line 4:本公司RISOTM RNA 抽提试剂;Line 5:国外某公司 RNA 抽提试剂
1.1 试剂耗材的准备:
1) 试剂:
A. RNase-Free 水:配0.01 % (v/v)的Diethylpyrocarbonate(DEPC)溶液,室温保持过夜,次日高压灭菌后,- 20 ℃ 保存。
B. 氯仿 (Chloroform),异丙醇(Isopropyl alcohol),分子生物学级别
C. 75% 乙醇 (用 DEPC-treated 水配制)
2) RNase 去除的耗材:用0.01% (v/v) DEPC 溶液完全浸泡过夜,高压灭菌后烘干。
1.2 实验步骤:
1) 准备分离RNA 的细胞:
I. 悬浮细胞:
收集细胞,离心200 g,5 min。吸出培养液。每106 个细胞加入1 mL Trizol 裂解液,反复吹吸3 - 5 次,室温下静置10 min 后转移至干净的离心管中。
II. 贴壁细胞:
吸出培养液,每10 cm2 生长面积的细胞加入1 mL Trizol 裂解液,反复吹吸3 - 5次,室温下静置10 min 后转移至干净的离心管中。
2) 加入0.2 mL 氯仿(/ mL Trizol),振荡15 sec 混匀后静置2 min。
3) 在4 oC,12,000 g 离心15 min,混合液分成三层。
(以下所有步骤用到耗材均需用DEPC 处理并高压灭菌。)
4) 小心吸取最上层的无色水层于干净的离心管中。加入0.5 mL 异丙醇(/ mL Trizol),室温下静置10 min。
5) 在4 oC,12,000 g 离心10 min,弃上清,加入1 mL 75% 乙醇(/ mL Trizol),振荡混匀。
6) 在4 oC,7,500 g 离心5 min,弃上清。室温下完全干燥5 - 10 min。
7) 加入RNase‐Free 水溶解RNA 沉淀,分装后在 ‐ 80 ℃ 保存。
2 实时定量荧光PCR
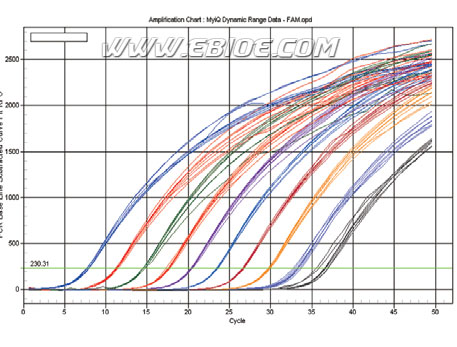
实时荧光定量PCR(Real Time PCR,qRT-PCR)避免了传统PCR 以终产物检测定量产生的偏差,提高实验的重复性。与常规PCR 相比,实时荧光定量PCR 具有特异性更强、有效解决PCR 污染问题、自动化程度高等特点,已成为国际公认的核酸分子定量的标准方法。该技术已被广泛用于检测细胞mRNA 表达量的变化;比较不同组织的mRNA 表达差异;验证基因芯片,siRNA 干扰的实验结果。它涉及到DNA 或RNA 样品制备,反转录及PCR 反应等一系列重要的分子生物学过程。
2.1 设计目的片段和内参基因的qPCR 引物:利用Primer5.0 等软件设计PCR 引物及探针。我们公司免费为客户设计引物和探针。
2.2 SYBR Green 法:
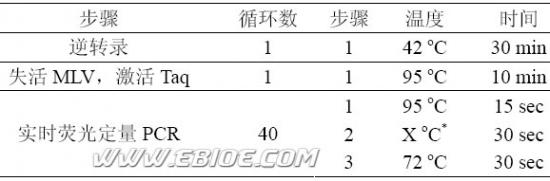
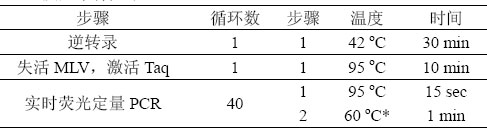
2) PCR 反应条件如下:
*与引物的Tm 相关
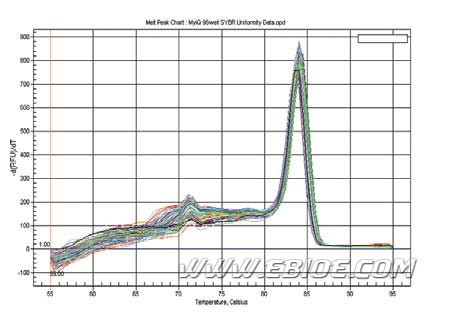
3) 取5μl PCR 产物跑1.5%琼脂糖凝胶电泳,或做溶解曲线,检测PCR 产物的特异性
2.3 Taqman 法
1) 建立以下反应体系
2) PCR 反应条件如下:
5.2.4 实验完毕之后,将数据导入到Excel 中进行数据分析。
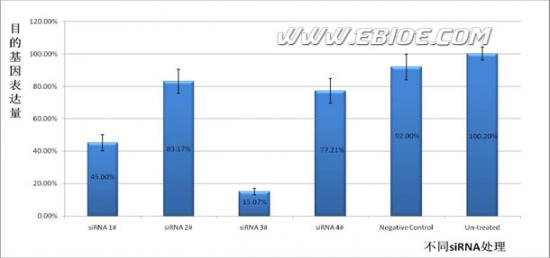
5.2.5 结果分析:
利用ΔΔCt 法,相对定量,将目的基因的表达与看家基因的表达对比,获得沉默效果。如下图所示: