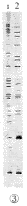梁德勇 徐国恒 崔振中 王晓民 朱丽霞 韩济生
RNA是分子生物学研究的一个重要组成部分, 不论是cDNA文库的构建、RT-PCR、RNA序列分析、差异显示(mRNA differential display)、代表性差异分析 (representational Difference Analysis, RDA)、抑制性消减杂交(suppression Subtraction Hybridization, SSH)、Northern印迹分析、蛋白质的体外翻译等均依赖于高纯度完整的RNA。 因此, 如何获得高质量的RNA是研究人员关注的问题。1987年Chomczynski等[1]建立了酸-异硫氰酸胍-苯酚-氯仿一步法(acid-guanidine-phenol-chloroform, AGPC)。该方法较以往的传统方法操作简单,无需特殊的设备,抽提时间缩短至4 h,因而得到广泛的应用。数家公司据此开发出RNA提取试剂盒[2,3]。使用试剂盒简单方便,但价格相对昂贵。为探索操作简便、经济实用、快速有效的RNA提取方法,我们分析了大量相关文献资料,进行了多次实验,成功地研制出一种新型的RNA提取试剂,建立了其操作程序,我们称之为RNA快速提取一步法。其性能达到进口试剂盒的水平,但造价低廉、操作简便,特别适用于国内实验室。
1 材料与方法
1.1 试剂
变性液(4 mol.L-1异硫氰酸胍,25 mmol.L-1柠檬酸钠pH 7.0,5 g.L-1十二烷基肌氨酸钠,0.1 mol.L-1β-巯基乙醇),按文献[1]方法配制;2 mol.L-1的乙酸钠;重蒸酚;氯仿;异丙醇;8-羟基喹啉;柠檬酸;柠檬酸钠;乙酸;乙酸钠;800 ml.L-1乙醇;RNAzol试剂盒(Promega 公司);Trireagent (Sigma 公司)。
1.2 仪器
电泳仪、岛津UV-160型紫外可见分光光度计(日本产)、超声匀浆仪(美国Sonics Material Inc. Jencons产品)、玻璃匀浆器。所用器皿均按RNA提取的一般要求进行处理[4]。
1.3 标本
大鼠脑组织、脊髓组织、培养细胞。
1.4 RNA快速提取试剂的制备
1.4.1 酸酚的平衡 取重蒸酚于65℃水浴融化, 加入1 g.L-18-羟基喹啉;用50 mmol.L-1乙酸钠(pH 4.0)平衡。在平衡的过程中不断搅拌,并反复更换乙酸钠,待上清液相的pH值达到4.1为止。
1.4.2 CSB缓冲液的配制 用DEPC处理过的纯水配制CSB缓冲液,由42 mmol.L-1柠檬酸钠、8.3 g.L-1十二烷基肌氨酸钠和0.1 mol.L-1β- 巯基乙醇组成。
1.4.3 快速RNA提取试剂的配制 用CSB缓冲液配制4 mol.L-1异硫氰酸胍;加入0.1体积4 mol.L-1乙酸钠(pH4.0), 加入等体积酸酚,0.02体积的异戊醇,混匀,即为RNA快速提取试剂。4℃保存备用。
1.5 RNA快速提取程序
组织RNA的提取: 将约10~100 mg的组织块置于匀浆仪中,加入1 ml RNA快速提取试剂,进行匀浆;将匀浆液倾入1.5 ml离心管中,加入0.1体积的氯仿,振荡混合20 s;冰上放置5 min;4℃离心12 000 r.min-1, 15 min。离心管中的液体分为3层: 上层为无色透明的无机相,RNA保留于此相中;下层为呈淡黄色的有机相,蛋白质保留于此相中;上下两层的界面处为中间层,DNA保留于此相中。小心吸取上层水相约0.5 ml于新管中,切勿吸取中间层和下层液体,以避免DNA和蛋白质的污染。异丙醇沉淀:加入等体积的-20℃预冷的异丙醇,混匀,4℃离心12 000 r.min-1,15 min, 弃上清;用0.5 ml预冷的80%(体积分数)乙醇洗涤沉淀,弃尽乙醇,在空气中自然干燥,溶于适量DEPC处理的水中,用于后续的实验或-80℃保存。培养细胞RNA的提取: 培养细胞生长至旺盛期,弃掉培养基,用冰冷的PBS缓冲液冲洗两次,直接向细胞中加入1~2 ml RNA快速提取试剂,轻轻晃动培养瓶使细胞与RNA快速提取试剂充分接触,冰上放置5 min,吸出粘稠的细胞裂解混合物于新的离心管中,加入0.1体积的氯仿,振荡混匀。其余步骤与上述组织RNA提取方法相同。传统一步法提取RNA,按文献[1]方法进行;用Trireagent 或RNAzol提取RNA,按试剂盒说明操作。
1.6 RNA的质量、纯度鉴定和浓度测定
取1~2 μl RNA样品在15 g.L-1琼脂糖凝胶上进行电泳,检查RNA的质量,主要观察28 S、18 S和5 S三条带是否清晰,有无降解,以及是否有DNA污染。
取1~2 μl RNA样品溶于1 ml超纯水中,用紫外分光光度法测定D值。以D260值计算其浓度,计算公式:
质量浓度(g.L-1)=40×D260× 稀释倍数/1000
以D260/D280的比值表示其纯度,比值在1.8~2.0之间为纯的 RNA,比值低于1.8,说明RNA样品有蛋白质或酚的污染,需要用氯仿重新抽提。
2 结果
2.1 RNA的完整性
用快速一步法提取的RNA进行琼脂糖凝胶电泳,显示清晰的28 S,18 S和5 S三条带,表明RNA无降解、无明显的DNA污染,图1给出了一个代表性的实验结果,图2是用传统方法提取的电泳图,有较多的DNA污染。紫外分光光度法检查,图1脑组织RNA样品D260/D280的比值均在1.8~2.0之间,说明RNA未被蛋白质、酚污染,是高纯度的。用两种试剂盒提取的RNA与本法结果相似(图略)。用快速一步法提取的关节炎大鼠脊髓RNA作模板,进行DDRT-PCR,获得成功(图 3)。
1,test;
图1 用快速一步法提取大鼠脑组织RNA的电泳图
Figure 1 Electrophoresis map of brain RNA by rapid one-step method
2,control.
图2 用传统方法提取大鼠脑组织RNA的电泳图
Figure 2 Electrophoresis map of brain RNA by acid-guanidine-phenol-chloroform (AGPC) method
图3 关节炎大鼠脊髓组织RNA样品的差异显示结果
Figure 3 Differential display map of spinal cord from arthritis rat
2.2 操作程序的比较
快速RNA提取方法与传统的一步法相比,省掉了变性液复溶和异丙醇二次沉淀.
同时也对其它参数进行了调整,使整个RNA的提取过程由原来的4 h缩短至1 h以内,这与试剂盒的方法一致。
见表1
表1 4种RNA提取方法的比较
Table 1 Comparison of four RNA extraction methods
| Steps | AGPC method |
One-step method (in this paper) |
RNAzol | Trireagent |
| Centrifuge | 20 min | 15 min | 15 min | 15 min |
| Precipitation | Isopropyl alcohol | Isopropyl alcohol | Isopropyl alcohol | Isopropyl alcohol |
| At least 60 min | 15 min | 15 min | 15 min | |
| Centrifuge | 20 min | 10 min | 10 min | 10 min |
| Re-dissolve | Denature Solution | no | no | no |
| Re-precipitation30 min | no | no |
no |
|
| Centrifuge | 10 min | no | no | no |
| Washing | 800 ml.L-1ethanol | 800 ml.L-1ethanol | 800 ml.L-1ethanol | 800 ml.L-1ethanol |
| Dissolve | H2O | H2O | H2O | H2O |
| Total time | 240 min | 60 min | 60 min | 60 min |
2.3 RNA快速提取试剂的稳定性
在实验中发现,按传统一步法配制的变性液稳定性不好,易出现浑浊,甚至析出结晶等不良现象。我们配制的RNA快速提取试剂4℃长期保存无浑浊、结晶析出等不良现象。用4℃保存3个月、6个月和12个月的试剂分别提取RNA,进行琼脂糖电泳鉴定无降解,表明该试剂具有很好的稳定性,可以长期保存使用,有效期至少是1年。
2.4 匀浆方式对RNA质量的影响
在实验中我们发现不同的匀浆方式对RNA的质量有明显的影响。通过反复实验发现,用超声匀浆仪匀浆易引起RNA的降解,且RNA的回收率很低;用手动玻璃匀浆器进行组织匀浆,获得的RNA无降解,回收率高,而且操作简单,是一种较理想的组织匀浆方式。
3 讨论
对任何一种RNA提取方式的评价,首先要评价该方法是否能获得高纯度完整的RNA,这是评价一种方法有效性的根本指标。本实验结果表明,以一步法为基础建立的RNA快速提取一步法能够获得高纯度完整的RNA,其效果优于传统的一步法,与目前市售的进口试剂盒的效果基本一致。
完整的RNA取决于最大限度地避免提取纯化过程中内源及外源性的核糖核酸酶(RNA酶)对RNA的降解。采用高活性的 RNA酶抑制剂是防止RNA降解的有效方法。异硫氰酸胍是已知作用最强的蛋白变性剂,它在裂解细胞释放RNA 的同时能迅速使RNA酶失活,避免RNA被降解[5]。酸性环境有利于胍盐活性的发挥,能最大限度地发挥其对RNA酶的抑制作用;十二烷基肌氨酸钠和酚是强的蛋白变性剂,对RNA酶也有一定的抑制作用,使细胞裂解产生的各种蛋白迅速变性。酸性环境下RNA、蛋白质和DNA分别进入不同的分布相中,RNA进入上层水相,蛋白质进入下层有机相,DNA则进入位于上下两层界面处的中间层。氯仿不但有一定的蛋白变性作用,而且能迅速使各相分离,使RNA与其它成份分开。因此,由上述成份组成的RNA快速提取试剂构成获得高纯度完整RNA的基础。
按传统的一步法提取RNA,所用各种试剂需要分别加入,操作环节多,这将增加外源RNA酶污染RNA使其降解的机会,从而增加了操作难度。RNA快速提取试剂则把多种所需试剂,组合在一个溶液体系中,使组织破碎和抽提只需加一次试剂代替了传统方法多次加入试剂,这不但使操作简化,而且减少了外源RNA酶污染的机会。RNA快速提取试剂的另一特点是把多种成份组合在一起,较各成份单独存放更加稳定,能够长期保存。另外,RNA快速提取方法简化了传统一步法的操作程序,去掉了变性液复溶和异丙醇再次沉淀的步骤,这不但使操作简化,而且使RNA丢失减少,回收率增加,同时使RNA的提取周期由原来的4 h缩短至1 h,这不但节省了时间,提高了工作效率,而且减少了RNA降解的机会。
匀浆方式是影响从组织提取高纯度完整RNA的重要因素。 我们曾用超声匀仪浆对脑组织进行超声匀浆,提取RNA,屡遭失败。分析其原因可能有两个方面,一是超声匀浆产生大量的热,使RNA降解,另一方面超声匀浆的冲击力太大且作用不均匀,致使RNA的完整性遭到破坏。
总之,通过对传统一步法的改进,建立了RNA快速提取试剂和操作程序即RNA快速一步法。该方法操作简单,高效快速,经济实用。我们曾用该方法提取数百个RNA样品,用于RT-PCR、差异显示基因的筛选等多方面,均获得成功,显示了广阔的应用前景。
注:国家自然科学基金(39600192)资助项目。
作者单位:梁德勇 徐国恒 崔振中 王晓民 韩济生 北京医科大学神经科学研究所,北京 100083
朱丽霞 中国中医研究院针灸研究所
参考文献
1 Chomcznki P, Sacchi N. Single-step method of RNA isolation by acid guanidine thiocyanate-phenol-chloroform extraction. Anal Biochem, 1987, 162:156-159
2 Chevillard S. A method for sequential extraction of RAN and DNA from the sample, specially designed for a limited supply of biological material. Biotechniques, 1993, 1:22-24
3 Chomczynski P. A reagent for the Single-step Simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. Biotechniques, 1993, 15:523-537
4 Sambrook P, Fritsch EF, Maniatis T. Molecular Cloning, A Laboratory Manual. Cold Spring Harbor. Cold Spring Harbor Laboratory Press, 1989.343-344
5 Han JH., Stratowa C, Rutter WJ. Isolation of full-length putative rat lysophosphipase cDNA using improved methods for mRNA isolation and cDNA cloning. Biochemisty, 1987, 26: 1617
6 Wallace DM.. Large- and small- scale Phenol extractions. Meth Enzymol, 1987, 152: 33~41