实验原理
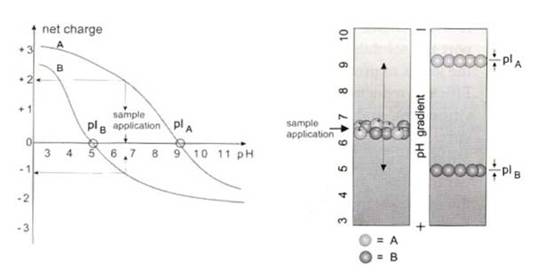
所有的氨基酸均为两性物质,即它们至少含有一個羧基(carboxyl)及一個氨基(α-amino)。這些可游离的基团随着pH变化可以三种形式存在,即正电荷(cation)、两性离子(zwitterion)及负电荷(anion)等三种,在酸性溶液中带正电荷,在碱性溶液中带负电荷。若氨基酸在某一pH值下其净电荷为0,且在电场中不移动时,称此pH值为它的pI值(等电点)。因为净电荷为零,净电斥力不存在的緣故,大部份蛋白质在等电点的pH值下,其溶解度最小。相反的,当溶液的pH值低于或高于pI,所有蛋白质分子所带净电荷为同号,彼此之间有相斥力,不会聚集。所以,將pH调到等电点的大小,则大部份的蛋白质將会沉淀,这种现象可以应用于估算某蛋白质的等电点;另一方面,也可以应用在电泳,达到分离蛋白质混合物的目的,这种方法称为等电聚焦电泳(isoelectric focusing),简称为IEF(见图4.8)。
图4.8 等电聚焦电泳示意图
上图左以A,B两种蛋白质为例,作出它们的净电荷曲线图,横轴代表环境中的pH值,纵轴代表蛋白質的净电荷,在 pH 6.5时,A带有两个正电荷,B带有一个负电荷。使A与B的净电荷为0的pH值分別为pH9和pH5,这就是它们的「等电点」。
IEF是在具有pH梯度环境中进行的电泳。将蛋白质置于不同pH梯度的胶体进行电泳,它会朝着与自身所带电荷相反的电极方向移动,直到抵达等电点(pI)相同的pH值处才停止,如果它移到別的pH处,会因为带电而再度移动到和它pI相符的pH处。
IEF-PAGE操作简单,只要一般电泳设备就可进行,电泳时间短、分別率高、应用范围广,可用于分离蛋白质及测定pI,也可用于临床鉴别诊断、农业、食品研究等各种领域。
试剂和器材
一、试剂
Acr-Bis贮存液:29.1g Acr,0.9g Bis, 用无离子水溶解后定容至100ml,不溶物过滤去除后置棕色瓶贮于冰箱。
等电点标准蛋白(pH3-pH10)试剂盒,临用前稀释至0.1-0.3mg/mL。
适合于pH3-pH10范围的电极溶液:
A: 阴极电极溶液(1mol/L NaOH):称NaOH(AR)4g,加去离子水使其溶解,冷却至室温再定容至100ml;
B: 阳极电极溶液(1mol/L H3PO4):取H3PO4(85%)6.7ml,加去离子水定容至100ml。
固定液:称取磺基水杨酸3.5g,三氯乙酸10ml,甲醇35ml,加去离子水至100ml。
染色液:称取考马斯亮蓝R250 0.1g,冰乙酸10ml,甲醇35ml,加去离子水使其完全溶解,在定容至100ml,过滤后置棕色瓶保存。
脱色液:取无水乙醇50ml,冰乙酸20ml,加蒸馏水至200ml。
保存液:取无水乙醇25ml,冰乙酸10ml, 甘油5ml,加蒸馏水至100ml。
10%过硫酸铵,TEMED, 40%两性电解质载体(pH3-pH10)。
二、材料
待测已纯化的蛋白质样品(脱盐),浓度0.5mg/mL。
三、器材
等电聚焦电泳槽, 移液管(1,5,10ml),烧杯(25,50,100ml),细长头的吸管,微量注射器(10μL或者50μL),漏斗,滤纸,镊子。
操作方法
一、准备工作
配制凝胶前,应把玻璃板准备好。即将两块干净的玻璃板叠放在一起,之间夹上所需凝胶厚度的胶条进行密封。然后用文具夹将玻璃板四周固定好。注意夹子作用力点在胶条正中,以防漏胶。
二、配制凝胶
取Acr-Bis储备液2.0ml;两性电解质0.5ml;去离子水5.5ml;TEMED 8μl置于小烧杯中混匀,再加入10% 过硫酸胺50μl,用磁力搅拌器充分混匀2min。然后用注射器吸净混合液,排除气泡,缓缓注入玻璃板的夹隙内。注意勿出现气泡。
三、电泳
1. 剥胶板 将胶板取出,揭去上层的玻璃板和胶条,然后用蒸馏水轻轻冲洗一下胶面。
2. 点样 用小纸条(0.5 cm′0.5cm)蘸样,均匀地点在胶板上,点样要求整齐、迅速。注意胶板两边要留出一定空间。通常把PI在酸性范围的样品放在偏碱性的位置(负极),PI偏酸性的样品放在偏酸性的位置(正极),标准蛋白质混合样品放在中间。
3. 进样 将浸入电极液的滤纸条取出,使其分别平直紧贴在胶面两端,然后放入电泳槽内,注意正负极相吻合。将电极板正极(电极条浸有H3PO4的一侧)与负极(电极条浸有NaOH的一侧)分别与电泳仪的正、负极连接。接通冷却水,在室温下电泳,把电泳仪调至电压50V,电流以每板胶不超过17mA为准,然后开始电泳。进样时间一般在1.5-2小时。
4. 揭样纸 待电流降至每板胶3mA以下时,切断电源,取出胶板,揭去加样纸后,将电压调至220~320V继续电泳。5. 加压 当电流降至每板胶3mA以下时,升高电压至580V,继续电泳1.5小时左右。
6. 电流降至每板3mA以下时,切断电源,停止电泳。
四、固定、,染色和脱色
将凝胶板放在培养皿中,加入固定液,浸泡数小时后,用脱色液清洗两次,每次10min, 然后加入染色液,室温下放置15-30min,再用脱色液洗脱数次,直至谱带清晰,放入保存液中浸泡10min,可制干板。
五、制作干胶板
1. 取完全浸湿的平整玻璃纸一张,于玻璃板上铺平,纸与板之间不可有气泡。
2. 将凝胶铺于上述玻璃纸上,对齐中心位置,使四边留出距离相等,随后将胶与纸之间的气泡轻轻赶跑。然后,把另一张玻璃纸折起盖在胶面上,并与下层玻璃纸对齐,胶与两层玻璃纸之间要绝对避免气泡,要求光滑平整。
3. 将凝胶四边上下两层玻璃纸贴紧,使胶边边缘上完全没有气泡。然后将各边的玻璃纸多余部分折向玻璃板反面。
4. 置于室温中自然干燥,完全干燥后的胶板,手感如触及玻璃板。这时,可将胶板揭下,裁去边角多余的纸,即可得一张图谱清晰的干胶板。
注意事项
(1)支持介质
在IEF-PAGE中,丙烯酰胺純度极为重要,Acr及Bis中如有丙烯酸,则引起聚焦后pH剃度漂移,一般需用重结晶法进一步纯化Acr及Bis。 最近Pharmacia公司推出Amberlite MB-6除去丙烯酸,其效果较再結晶法更佳。
(2)两性电解质载体
两性电解质载体是IEF-PAGE中最关键的试剂,直接影响pH梯度的形成,以及蛋白質
的聚焦。因此,要选用优质的两性电解质载体,在凝胶中,其终浓度一般为1-2%。pH梯度的线性依赖于两性电解质的性质,选择哪种pH梯度范围的两性电解质载体,則与被分离蛋白质的pI有关。
(3)样品预处理与加样方法
实验证实,盐离子可干扰pH梯度形成,并使区带扭曲。为了防止上述影响,进行IEF-PAGE时,样品应透析或用Sephadex G-25脱盐,也可将样品溶解在水,或是低盐缓冲液中,使其充分溶解,以免不溶小顆粒引起拖尾。但某些蛋白质在等电点附近,或水溶液及低盐溶液中,溶解度较低,則可在样品中加入两性电解质,如加入1%甘氨酸或对1%甘氨酸透析,虽然甘氨酸是两性电解质,但不影响pH梯度的形成,可利用其在溶液中的偶极距作用增加蛋白質的溶解性。此外,还可在样品及凝胶溶液中加入无离子去污剂如Tween 80, Triton X-100, Nonide P-40等或加入相同浓度的尿素(4 M),以免氰酸盐引起蛋白质的胺甲酰化,含有尿素的样品及凝胶板只能当天使用。
加样量取决于样品中蛋白质的种类、数目及检测方法的灵敏度。如用银染色,加样量可减少到1 μg。一般样品浓度以0.5-3 mg/ml为宜,最适加样体积为10-30 μl。如样品很浓,可直接在凝胶表面加2-5 μl;如样品很稀,可加样300μl。值得注意的是:对不稳定的样品可先将凝胶进行15-30 min预电泳使pH梯度形成,然后将样品放再靠近pI的位置以缩短电泳的时间,但不要将样品正好加在pI处和紧靠阳、阴极的胶面上,以免引起蛋白质变性造成区带扭曲。一般加样电泳半小时后,取出加样滤纸以免引起拖尾現象。
(4)电功率、时间等因素
在IEF电泳中,随着样品的迁移越接近pI时,电流则越来越小。为使各成分能更好
地分离,要保持一定的电功率,就应不断增加电压,电压增高可缩短pH梯度形成,和蛋白质分离所需的时间,但过高的电压会使凝胶板局部范围过热,因此,在电泳过程中,应通冷却水,水温以4-10℃为宜,流量5-10 l/min。一般宽pH范围电泳时间以1.5-2 h为宜。