SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的分子量(垂直板型电泳)
一、目的:
1.学习SDS-PAGE测定蛋白质分子量的基本原理。>
2.掌握垂直板型电泳的基本操作技术。>
二、原理:
由实验十五中已知,蛋白质在聚丙烯酰胺凝胶中电泳时,它的迁移率取决于它所带净电荷以及分子的大小和形状等因素。
1967年,Shapiro等人发现,如果在聚丙烯酰胺凝胶系统中加入阴离子去污剂十二烷基磺酸钠(sodium dodecyl sulfate,简称SDS),则蛋白质分子的电泳迁移率主要取决于它的分子量,而与所带电荷和形状无关。在一定条件下,蛋白质的分子量与电泳迁移率间的关系,可用下式表示:
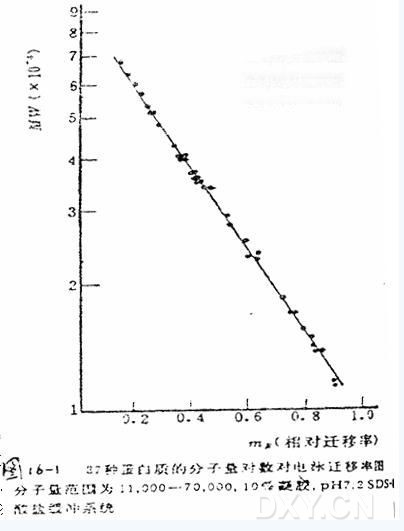
因此,测定某个蛋白质的分子量,只需比较它和一系列已知分子量的蛋白质在SDS-凝胶电泳时的迁移率就可以了。后来,Weber等人基本按Shapiro的方法对约40种蛋白质进行了研究,进一步证实了这个方法地可行性(见图16-1)。用这种方法测定蛋白质的分子量,简便、快速,只需要廉价的设备和微克量的蛋白质样品;所得结果,在分子量为15,000~200,000的范围内,与用其他方法测得的分子量相比,误差一般在±10%以内。因此,近几年来,SDS-凝胶电泳测定分子量的方法,已得到非常广泛的应用和迅速的发展。
为了阐明SDS-凝胶电泳法测定蛋白质分子量的原理,许多人进行了深入的研究。实验证明,在蛋白质溶液中加入SDS和巯基乙醇后,巯基乙醇能使蛋白质分子中的二硫键还原;SDS能使蛋白质的氢键、疏水键打开,并结合到蛋白质分子上,形成蛋白质-SDS复合物。在一定条件下,SDS与大多数蛋白质的结合比为1.4克SDS/1克蛋白质。由于十二烷基磺酸根带负电,使各种蛋白质的SDS-复合物都带上相同密度的负电荷,它的量大大超过了蛋白质分子原有的电荷量,因而掩盖了不同种类蛋白质间原有的电荷差别。
SDS与蛋白质结合后,还引起了蛋白质构象的改变。蛋白质-SDS复合物的流体力学和光学性质表明,它们在水溶液中的形状,近似于雪匣烟形的长椭圆棒,不同蛋白质的SDS复合物的短轴长度都一样,约为18A,而长轴则随蛋白质的分子量成正比地变化。
这样的蛋白质-SDS复合物,在凝胶电泳中的迁移率,不再受蛋白质原有电荷和形状的影响,而只是椭圆棒的长度也就是蛋白质分子量的函数。
将蛋白质-SDS复合物在不同浓度的SDS-凝胶中电泳,得到的结果按Ferguson公式作图,也证明了蛋白质-SDS复合物的上述性质。
Ferguson公式:1gmR=1gm0-KRC
该公式原来是Ferguson提出来描述蛋白质在淀粉凝胶中电泳行为的,后来证明它也同样适用于聚丙烯酰胺凝胶电泳,式中mR是蛋白质在一定浓度凝胶(C)中的迁移率;m0是当凝胶浓度外推到零时的迁移率即自由迁移率,它与蛋白质的净电荷量(q)成正比,与蛋白质在溶液中的摩擦系数(f)成反比(m0∝q/f,f由溶液的粘滞性、蛋白质分子的大小和形状决定);KR是阻滞系数(retardation coefficient),它与蛋白质分子量成线性关系。因此,不同的蛋白质分子有不同的mR、m0和KR值,几种蛋白质的Ferguson图见图16-2。

从图16-3可以清楚地看到,不同蛋白质的SDS复合物的m0值都很接近,分子量相差5倍的蛋白质之间,m0值只相差10%,如果忽略这个差别,就可以认为,各种蛋白质-SDS复合物的m0基本上是一个定值。这表明,不同蛋白质的SDS复合物都带有相同密度的负电荷,并具有同样的构象,因此,它们的净电荷量与磨擦系数之比(q/f)都接近于一个定值而不受各种蛋白质原来的电荷、分子大小和形状的影响,因而,在溶液中,自由迁移率就表现出一致性;但在一定浓度的凝胶中,由于引入了凝胶的分子筛效应,电泳迁移率mR就成为蛋白质分子量的函数。
根据以上事实,可以认为SDS-凝胶电泳测定蛋白质分子量方法的基础是可靠的。当然,还有许多问题有待于更深入地研究。







