O. Henegariu, N.A. Heerema, S.R. Dlouhy, G.H. Vance and P.H. Vogt
Indiana University, Indianapoils, IN, USA and Heidelberg University, Heidelberg, Germany
摘要:
多重 PCR 通过在同一个反应中同时完成多个基因的扩增成为临床与基础研究领域中一种简便快捷的筛选检测方法。已有大量文献详细的讨论了通常影响 PCR 反应质量的条件,而在多重 PCR 中常见的困难和重要的实验因素却鲜见报道。本文使用多对引物对多重 PCR 的各种条件进行了研究。研究表明,对于成功进行多重 PCR 尤为重要的因素是:用于扩增不同基因的不同引物对之间的相对浓度、 PCR 缓冲液的浓度、循环温度、氯化镁和 dNTP 浓度间的平衡。在实验的基础上,本文给出了一个多重 PCR 的标准方法,并给出常见问题的解决办法。
多重 PCR 就是在同一个反应管中同时完成多个不同基因扩增的 PCR 反应。这一方法最早报道于 1988 年 ( 6 ) ,已被成功的用于缺失分析 ( 2,8 ) ,突变 ( 14 ) 与多态性 ( 11 ) ,以及定量分析 ( 10 ) 与反转录 PCR ( 7 ) 等多个 DNA 检测领域。
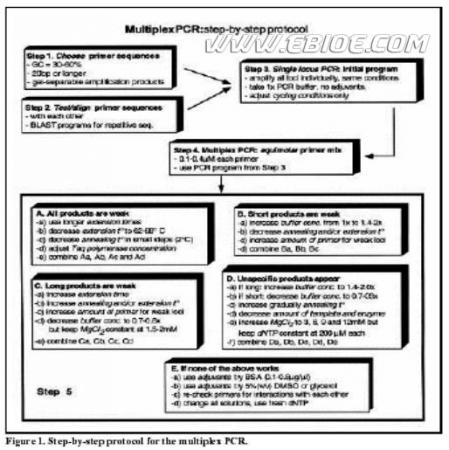
PCR 反应中各种试剂的作用已被讨论过 ( 3,9,12,13 ) ,也已有许多研究团体对多重 PCR 的方法进行了描述。但是很少有人对影响多重 PCR 结果的因素(如引物浓度、循环条件等)进行过深入的讨论 ( 5,15 ) 。本实验使用常规含 KCl 的 PCR 缓冲液对 50 种基因的各种组合进行了多重 PCR 反应,针对伴随多重 PCR 的一些问题,如均一性差、某些基因难以扩出、重复性差等问题,对影响扩增的相关参数进行了研究。基于实验经验我们设计了多重 PCR 的标准方法 (Figure 1) ,并提供了对可能碰到的许多问题的解决方案,这对于临床与基础研究领域中使用 PCR 技术的工作者都会有所帮助。
材料与方法:
PCR使用的标准溶液和试剂
100 mM 母液的核苷酸 (dNTP) ( 购于 Pharmacia Biotech [Piscataway, NJ, USA] 或 Boehringer Mannheim [Indianapolis, IN, USA]) (25 mM each dATP, dCTP, dGTP and dTTP).
标准的 10xPCR 缓冲液 (Perkin-Elmer, Norwalk, CT, USA) 包含: 500 mM KCl, 100 mM Tris-HCl, pH 8.3[at 24 ℃ ], 15 mM MgCl 2 .
Taq DNA 聚合酶 (Life Technologies [Gaithersburg, MD, USA]; Perkin-Elmer).
二甲亚砜 (DMSO), 牛血清蛋白 (BSA), 甘油 (Sigma Chemical [St. Louis, MO, USA])
引物 (Genosys [The Woodlands, TX, USA]; Research Genetics [Huntsville, AL, USA])( 终浓度为 10–25 pmol/μL 。引物对 sY 用作检测 Y 染色体上的缺失 (8,16) ;还有 10–15 对引物用于检测 X 染色体上迪谢内肌营养不良基因 (DMD) (4) ;其余引物用于检测 12 号染色体上的多态性位点,引物按 Table 1 和 Figures 2b, 3b,5e 方案组合。
基因组 DNA 使用标准 SDS/ 蛋白酶 K 方法制备 (Boehringer Mannheim)
基本 PCR程序
PCR 反应体积为 25μL ,包括:灭菌的超纯水、 PCR 缓冲液 (1x) 、 dNTP 混合物 (200μM each) 、引物 (0.04–0.6μM each); DMSO, 甘油或 BSA (5%); Taq DNA 聚合酶 (1–2 U/25μL) 和基因组 DNA 模板 (150ng/25μL) 。先加入水,其它组分可以任意顺序加入,加样在冰上进行,加样完成后反应管直接从冰上转入预热到 94 ℃的循环仪加热模块或水浴中。对于放射性标记的反应,在反应开始前立即在 100μL 的反应混合液中加入 1 μCi [ 32 P] dCTP (Amersham, Arlington Heights, IL,USA) 。使用 100μL 、 25μL 、 6.2μL 反应体积得到的结果相同,对于小的反应体积,加样(尤其是 dNTP )至关重要。实验中使用了各种 PCR 仪,经过细微调节后都得到了好的实验结果。
PCR产物的凝胶分析
在 3%SeaKem ? LE 或 NuSieve ? (3:1) 琼脂糖凝胶 (FMC BioProducts, Rockland, ME, USA) 上对 X 、 Y 染色体上非多态性位点的 PCR 产物进行分离,电泳缓冲液分别为 1xTAE [0.04M Tris-acetate; 0.001 M EDTA (pH8.0)] 或 1xTBE [0.09 M Tris-borate; 0.002 M EDTA (pH 8.0)] 缓冲液,电泳在室温下进行,电场强度为 7–10V/cm 。 PCR 产物的上样体积相同,电泳后凝胶用 0.5–1 μ g/mL EB 染色。
当检测位点为多态性位点或需要更高的分辨率时使用测序胶 (6% 聚丙烯酰胺 [PAA]/7 M 尿素 ) 。与上样缓冲液混匀后,每泳道加入约 0.2 μ L 放射性标记的 PCR 产物。凝胶在 0.6xTBE 缓冲液中在 1800–2000 V (60A) 条件下电泳两小时。过夜曝光后得到自显影图像。
结果与讨论 :
在大量实验的基础上,如 Figure1 所示设计出了多重 PCR 的标准方法,其中也包括了许多经常遇到的问题的解决方案。为了便于使用,用斜体字将步骤表与材料和方法中的各点及以下部分联系起来。