实验目的:
以cDNA为模板,利用PCR技术制备目的基因甘油醛-3-磷酸脱氢酶(Glyceraldehyde 3-phosphate dehydrogenase,GAPDH)的大量拷贝,以便进行目的基因的克隆;此实验还包括PCR引物设计,PCR产物的琼脂糖电泳检测等内容。
实验原理:
真核细胞含有三类基本RNA:核糖体RNA(rRNA)、信使RNA(mRNA)、转移RNA(tRNA)。其中mRNA传递合成蛋白质的全部遗传信息,是蛋白质生物合成的中间环节,具有特殊意义。Trizol试剂可从细胞中快速提取细胞总RNA,将其中的mRNA逆转录成cDNA,以一对特异性引物对目的cDNA进行聚合酶链式反应扩增。由于每个循环中合成的引物延伸产物可作为下一循环中的模板,因而每次循环中靶DNA的拷贝数呈几何级数增长,因此,30次PCR循环将产生约1亿倍(230)的扩增片段。
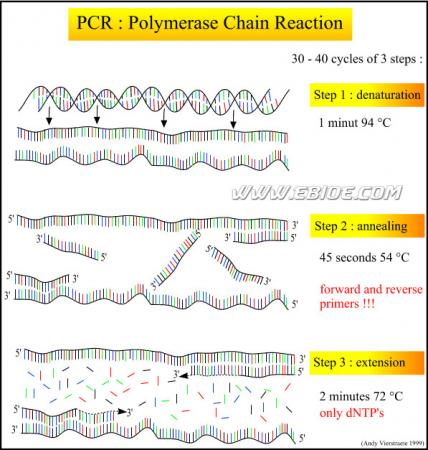
PCR技术又称聚合酶链反应(Polymerase Chain Reaction)技术,是一种在体外(试管)扩增核酸的技术。该技术模拟体内天然DNA的复制过程。其基本原理是在模板、引物、4种dNTP和耐热DNA聚合酶(Taq DNA polymerase)存在的条件下,特异扩增位于两段已知序列之间的DNA区段的酶促合成反应。每一循环包括高温变性、低温退火、中温延伸三步反应。每一循环的产物作为下一个循环的模板,如此循环30次,介于两个引物之间的新生DNA片段理论上达到230拷贝(约为109个分子)。PCR技术的特异性取决于引物与模板结合的特异性(图3-1)。PCR反应的基本步骤包括高温变性(denaturation);低温退火(annealing);中温延伸(extension)三步反应(图3-2)。
①变性(denaturation)(95℃);②退火(annealing);③延伸(elogation)(72℃)
图3-1 PCR扩增DNA原理示意图
图3-2
PCR实验中各种组分的剂量:
(1)dNTP常用浓度为20~200μM,不能低于10~15μM。
(2)引物浓度一般在0.1~1.0μM。
(3)Mg2+ 浓度范围通常为0.5~2mM。(3)在100μl PCR反应中,1.5~2U的Taq DNA聚合酶就足以进行30轮循环。
(4)一般反应中的模板数量为102~105 个拷贝,对于单拷贝基因,这需要0.1μg的人基因组DNA,10ng的酵母DNA,1ng的大肠杆菌DNA;扩增多拷贝序列时,用量更少。
(5)反应缓冲液:反应缓冲液一般含10~50mM Tris-HCl (20℃下pH8.3-8.8),50mM KCl和适当浓度的Mg2+。Tris-HCl在20℃时pH为8.3-8.8,但在实际PCR反应中,pH为6.8-7.8。 50mM的KCl有利于引物的退火。另外,反应液可加入5mM的二硫苏糖醇(DDT)或100μg/ml的牛血清白蛋白(BSA),它们可稳定酶活性。各种Taq DNA聚合酶商品都有自己特定的一些缓冲液。
PCR既可以扩增制备全长基因(图3-3),也可以扩增基因片段(图3-4)。
图3-3 PCR扩增全长基因
图3-4 PCR扩增基因片段
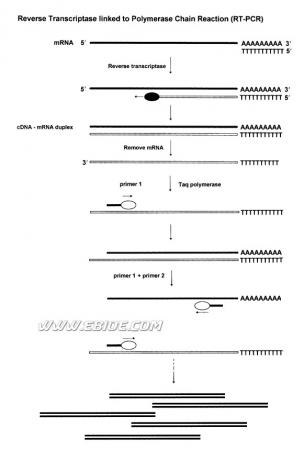
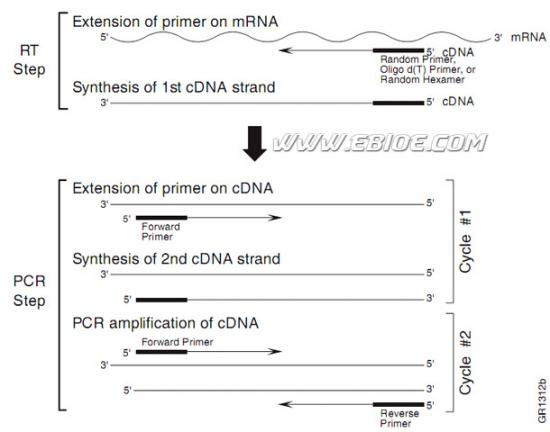
Two-step RT-PCR
实验材料:
[1].cDNA:实验2获得的cDNA。使用前用紫外分光广度计测定浓度。
[2].taq酶:5U/μl;附带10×PCR buffer (w/Mg):20mM MgSO4, 100mM KCl, 80mM (NH4)2SO4, 100mM Tris-HCl, pH9.0, 0.5% NP-40。上海申能博彩生物科技有限公司。
[3].4×dNTP混合物:10mM每种单核苷酸(dATP、dTTP、dGTP、dCTP);上海申能博彩生物科技有限公司。
[4].小鼠GAPDH基因PCR扩增引物(扩增产物168bp):
GAPDH-F1:5'- DIG/Biotin-GTGGCAAAGTGGAGATTGTT-3' Tm值:54.8℃
GAPDH-R1:5'- DIG/ Biotin-CTCGCTCCTGGAAGATGG-3' Tm值:55.7℃
[5].小鼠GAPDH全长基因PCR扩增引物(扩增产物1002+14 bp):
GAPDH-F2:5′- GCGGGTACCATGGTGAAGGTCGGTGTGAACGG-3′
GAPDH-R2:5′-CGCGTCGACTTACTCCTTGGAGGCCATGTAGG-3′
上游引物内含KpnI酶切位点(下划线者);下游引物内含Sal I酶切位点。
[6].小鼠 β-actin基因PCR扩增引物(扩增产物156 bp):
β-actin-F:5'-CATCACTATCGGCAATGAGC-3'
β-actin-R:5'-GACAGCACTGTGTTGGCATA-3'
[7].DNA marker:
[8].琼脂糖:
[9].溴化乙锭 (EB):10mg/ml水溶液。
[10].6×凝胶载样缓冲液:0.25% 溴芬蓝,0.25%二甲苯青FF,40%(w/v)蔗糖。
注意:在0.5~1.4%的琼脂糖凝胶中,溴芬蓝的泳动速率是二甲苯青FF的2.2倍;溴芬蓝的泳动速率约与300bp的双链线状DNA的泳动速率相同,而二甲苯青FF的泳动速率约与4kb的双链线状DNA的泳动速率相同。因此,两种染料可指示DNA在凝胶电泳中的迁移位置,判断电泳是否应该停止。
实验步骤:
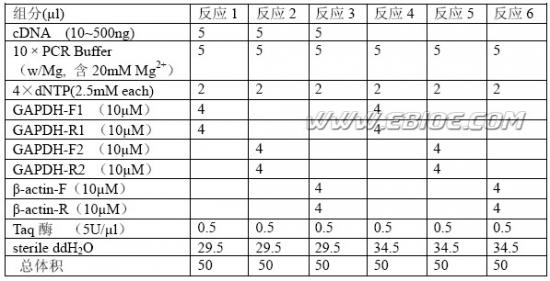
1、半定量PCR反应
[1].按顺序将下表各成分加入200μl薄壁PCR管:
[2].将PCR反应管瞬时离心,混匀反应液;
[3].将PCR反应管置于PCR仪上,盖好PCR仪顶盖。
[4].执行下列程序:94℃预变性3 min;30个循环:94℃变性45s, 57.6℃复性40s, 72℃延伸1.5min;72℃延伸10min;4℃保温。
2、PCR产物电泳分析
[1].配制1.0%琼脂糖凝胶,加入终浓度为0.5μg/ml的溴化乙锭(EB);
[2].取5μl PCR终产物及DNA marker,以0.5×TBE为缓冲液,电压100V电泳。期间根据溴芬蓝和二甲苯青FF在凝胶中的迁移位置及其欲检测的靶DNA分子的大小决定电泳是否已经达到应该停止的时间;若达到,停止电泳。
[3].紫外透射仪或凝胶照相仪上观察DNA扩增情况;依据DNA marker判断是否有预期的扩增产物;评价扩增条件:特别是扩增程序的复性温度(决定扩增产物的特异性)。
[4].用凝胶照相系统观察凝胶图象并拍照保存;用凝胶照相系统附带的分析软件对PCR产物条带进行区带密度分析;
[5].计算目的基因(GAPDH)的区带与内参(β-actin)区带的密度比,结果表示目的基因与内参 mRNA的比值。
注意事项:
小鼠GAPDH基因引物F1/R1 PCR扩增引物(扩增产物168 bp)5' 端带有DIG标记(也可以使用其他标记,如Biotin等)的目的是回收纯化PCR产物,用于后面的实验中做核酸杂交探针。