李爱丽1 ,2 姜涛1 马峙英2 贾继增1
( 1中国农业科学院作物品种资源研究所 农业部作物种质资源与生物技术重点开放实验室,北京100081 ;
2 河北农业大学农学院,保定 071001)
摘 要: 结合作者的工作实际,着重介绍了有效提高PCR 产物的几种方法:如怎样高效快速地设计PCR 引
物, 怎样尽快确定PCR 反应的最适退火温度,如何提高GC 富集区的扩增效率等,为分子生物学工作者提供一些可
以借鉴的方法及经验。
关键词: 聚合酶链式反应 PCR 引物 GC 富集区 梯度PCR
Several Methodologies on Improving the PCR Products
Li Aili1 , 2 J iang Tao1 Ma Zhiying2 J ia J izeng1
( 1 Key L aboratory of Crop Germplasm Resources and Biotechnology Mi nist ry of A gricult ure Instit ute of
Crop Germplasm Resources Chi nese Academy of A gricult ural Sciences , Beiji ng 100081 ;
2A gricult ural University of HeBei , Baodi ng 071001)
Abstract : Combining the author’s working experiences , we introduce here several methodologies on improving the
PCR products , such as the disciplines which we should abide by when we design PCR primers ; how to determine the ap-propriate annealing temperature of the PCR reaction ; how to improve the amplifying efficiency of the GC rich region. We hope to provide some methodologies for those who do research in microbiology.
Key words : Polymerase chain reaction PCR primer GC rich region Gradient PCR
聚合酶链式反应(polymerase chain reaction ,PCR) 最早由Mullis 于1987 年发明,现已成为实验室常规的操作,并已实现自动化。随着该技术的日趋成熟与完善,它已被广泛应用于分子生物学研究的各个领域。采用PCR 技术可以有效地从基因组DNA 或cDNA 文库中扩增目的基因,用以改良农作物或其它有用生物的性状,为人类造福。但在实际操作中,PCR 引物设计, PCR 反应最适退火温度的选择以及GC 富集区的扩增效率等问题常常成为该技术的制约因素,导致较长时间内扩增失败,耗费大量时间,精力,物力。笔者在这方面积累了一些工作经验,现整理如下,以供参考。
1 引物设计
1. 1 计算机软件辅助设计
PCR 引物设计是PCR 反应能否进行的关键。目前,可用于PCR 引物设计的软件非常多, 例如DNAstar ,Oligo6 ,Primer3 等。常用的是DNAstar 软件包中的Primerselect 。假如有一条基因序列需要设计引物,先要把这条序列保存为. txt 文件,然后利用DNAstar 中的Edit seq 把纯文本文件转换为. seq文件,这样就可以进行引物设计了。对于引物参数的取值可根据自己实验的要求来设置。通常情况下,应用软件设计引物具有方便,快速等优点。但是对于一些有特殊要求的PCR 反应来说,例如SNP的DASH 检测,其PCR 引物设计应用上述软件均不能获得有效引物,这时,实验者就应考虑根据PCR引物设计的原则并结合自己的经验设计引物。
1. 2 引物设计原则
在设计引物时,应注意遵循以下原则。
(1) 引物的长度一般在17~24 个寡核苷酸。
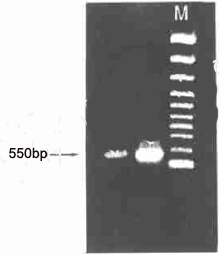
如果退火温度在54 ℃或稍高即能保证PCR 扩增的特异性和有效性,尽量缩短引物的长度可提高PCR扩增效率;如果扩增片段异源性较强,如同工型(io-form) 或利用一种植物已知基因序列扩增另一植物中基因时,应适当增加引物长度,引物可增至28~35 个碱基,从而提高PCR 扩增的特异性。如我们在应用拟南芥抗白粉病基因RPW8 1 应用于RT2PCR 的引物RPW81C 来扩增小麦基因组时,选用的基因长度上下链均为33bp ,
Forword :5′-CCGGAATTCATGCCGATTGGTGAGCTTGCGATA-3′
Reverse : 5′-CGCGGATCCTCAAGCTCTTATTTTACTACAAGC-3′
一次即获得了特异性较高的PCR 产物(图1) 。
图1 用引物RPW81C 进行RT-PCR 的扩增结果
(2) 引物自身以及引物间应防止产生引物二聚体;引物链内应防止发夹结构的形成,这些因素都将直接导致PCR 扩增失败。
(3) 引物5′端最好为G 或C ,3′端最好为A 或T。合理的GC 含量应占全链的50 %左右。引物链中部GC 含量应适当高一些。但应避免连续的GG,CC ,AA 和TT 对。
2 最适退火温度的选择
应用软件设计出的引物,计算机会自动给出最适退火温度;人工设计的引物也可根据公式Tm =4 ℃( G+ C) + 2 ℃(A + T) 计算最适退火温度。但在实际操作中,一般情况下,软件给出的最适退火温度及通过公式计算出的退火温度均不能保证PCR 扩增的有效性,这主要是由于实际Tm 值受各种缓冲液成分、引物和模板浓度的影响等。过去对于最适退火温度的选择需要分别设置引物、模板、MgCl2浓度及Taq 酶用量的梯度变化,通过多次PCR 反应才能完成。选择PCR 反应最适退火温度最方便、有效的方法是通过梯度PCR( Gradient PCR) 。梯度范围
选择在50 ℃~70 ℃范围内,一般一次PCR 即可选择出PCR 的最适退火温度(图2 , 图3) 。如果在50 ℃~70 ℃范围内没有找到最适退火温度,则应根据涂抹( Smear) 带出现的范围再次选择梯度范围。一般两次梯度PCR 仍未找到最适退火温度,则应考虑重新设计引物。
3 有效防止引物二聚体的产生
由于一般的DNA 聚合酶在低温下仍具有活性,因此常规PCR 中反应混合物内引物与模板及引物自身可以部分发生非特异性复性,导致非特异性扩增及引物二聚体/ 多聚体的形成。在引物设计时,应尽可能地减少引物间连续碱基配对的情况,这是防止引物二聚体产生的最有效办法。
另外在实际操作中,PCR 反应的热启动( hot2start ) 也能有效防止引物二聚体的产生(图4) 。使用热启动PCR ,即在高温( < 70 ℃) 下加入某种必需因子(通常为DNA 聚合酶) 。
一方面通过扩增前的加热,使双链模板充分解链;另一方面,通过高温热启动反应,促进引物的特异性复性与延伸,增加有效引物的长度,提高反应的有效性与灵敏性,并减少引物二聚体/ 多聚体的形成。在扩增样品数较少的情况下,一般采用先使模块升温后,再加酶的方法。如果扩增样品数较多,则应选用热启始的酶。
4 使用PCR 反应增效剂(enhancer)
GC 富集区由于较高的解链温度常使它不能被顺利扩增。在PCR 反应体系中加入1 %~10 %的二甲基亚砜,有助于提高GC 富集区的扩增效率。
二甲基亚砜属于有机溶剂(Organic solvent) ,其作用机制可能是由于有机溶剂在DNA 的水溶液中通过脱水(dehydration) 作用,导致DNA 结构的不稳定性, 从而功能性降低GC富集区的熔点及解链温度,提高扩增效率。据报道,每10 %的二甲基亚砜降低熔点及解链温度5. 5 ℃~6 ℃。有机溶剂的使用终浓度有一定范围,对于二甲基亚砜, 其终浓度为1 %~10 % , 不能超过10 % , 最适浓度为5 %。我们实验室常用的反应体系为图5 引物mlo5 初级扩增及次级扩增结果5 %。
5 巢式PCR(ne st PCR)
巢式及半巢式PCR 可以在减少或去除非特异性产物的同
时大大提高PCR 反应的灵敏性。所谓巢式,是指用一对初级引物(巢外引物) 于标准条件或更严格的条件下扩增靶序列,然后以初级PCR 产物为模板,用位于初级引物内侧的一对次级引物(巢内引物) 进行次级扩增,由于经过次级PCR 一个指数级的扩增,初级产物哪怕只有几个拷贝的靶序列被扩增,其次级PCR 产物的量仍会是足够用于分析的。
同时,由于次级引物位于初级引物的内侧,就保证了次级PCR 中只有正确的产物才得以扩增,从而大大提高了PCR 反应的特异性及灵敏性。所谓半巢式, ,是指只有一个次级引物位于初级引物的内侧,其余与巢式相似。我们实验室在利用大麦抗白粉病基因mlo 序列设计引物扩增小麦基因组DNA 时,即采用半巢式PCR (图5) 。初级引物(巢外引物) 上链为5′-GATCGGGCTGAGCATCATGAAG-3′, 下链为5′CCTATGTTGGCTATACATTGGG-3′;次级引物(巢外引物) 为上链5′-TCATCACCCGTG
CACCTGCTTC- 3′,下链与初级引物下链相同。初级引物扩增程序为Touchdown PCR ;初级扩增产物稀释20 倍后作为次级PCR 反应的模板,扩增程序为94 ℃3min , 94 ℃1min , 55 ℃1min , 72 ℃1min , 35 cy2cles ,72 ℃10min。通过Touchdown 与半巢式PCR 反应的结合,使该PCR 反应的特异性和有效性大大提高。
综上所述,当我们在实际工作中遇到某些PCR反应难于进行时,可尝试采用上面一种或同时采用几种方法进行操作,以提高PCR 反应的扩增效率。
参考文献
1 汤熙翔. 国外医学遗传学分册,1999 ,22 (3) :120~123.
2 张学敏,王宜强. 靶向新基因的分子克隆策略- 理论与方法,北京:
军事医学科学出版社.
3 D’Aquila RT , et al. Nucleic Acids Res ,1991 ,19 :3749.
4 Zimmeermann K,et al. Biotechniques ,1994 ,17 :18.
5 Zhang XY, et al. Biotechniques ,1994 ,16 :502.
6 Cheng S ,et al. Proc Natl Acad Sci USA ,1994 ,91 :5695.