一、外周静脉血DNA提取
(一)目的与要求
1、 了解外周静脉血DNA提取的常见方法及其原理
2、 掌握法医学上常用的chelex100法及其原理,并能熟练操作。
(二)常见方法
目前基因组DNA的提取方法较多,如酚/氯仿、尿素提取法、氯化锌法、三乙醇月桂基硫酸盐法、碘化物法、直接煮沸法等等。
样本:人外周静脉抗凝血。分别采集外周静脉血5ml,2%乙二胺四乙酸二钠(EDTA)抗凝待用(要求采血至分离白细胞之间隔时间在室温下放置不超过2h,4℃放置不超过5h,以防白细胞自溶)。
1. 酚/氯仿/异戊醇法
1.1原 理:
通过酚-氯仿混合物萃取DNA溶液中的蛋白质类有机物质,而保留DNA于水相溶液中。适用所有生物检材,其提取DNA量比Chelex法和无机盐提取法多,且 DNA分子结构完整,特别适合RFLP、测序等需要大分子DNA分析技术。
1.2 仪器设备与试剂
1.2.1 仪器设备:
微型高速离心机:可使用1.5ml离心管,最高转速13000r/min
56℃干热器:5~100℃可调,误差小于1℃
移液器:10ul、100ul、1000ul可调移液器,误差小于1ul
1.2.2 试剂:
1×SSC
0.2和2mol/L醋酸钠
10%SDS
蛋白酶K:(20mg/ml)
酚:氯仿:异戊醇(25:24:1)
1×TE
70%和100%乙醇
1.3 步 骤:
(1) 采集血样放入含有EDTA真空管,用前充分混匀。取1.5ml带盖微型离心管吸700ml血样冷冻保存备用。
(2) 37℃培育冷冻血样,加1×SSC 800ul混合。离心,13000rpm,1min,弃上清。
(3) 加1.0ml 1×SSC振荡,离心,13000rpm,1min,弃上清。注意避免触动沉淀物形成的团(Pellet)。
(4) 加375ul 0.2mol/L醋酸钠,振荡使沉淀物悬浮,加10%SDS 25ul和蛋白酶K 5ul,旋涡振荡,56℃培育1h
(5) 加等体积的酚/氯仿/异戊醇,旋涡振荡30s。
(6) 在微型离心机上2000rpm,离心2min。
(7) 仔细吸取水相转移到另一新的1.5ml微型离心管。注意避免吸到在分界面上积聚的变性蛋白,弃去剩余酚和变性蛋白。
(9) 加1ul 100% 冷乙醇,倒转混匀,置于-20℃冰箱15min。
(10)加180ul 1×TE,旋涡振荡使Pellet散开, 56℃孵育10min。加入20ul 2mol/L醋酸钠,倒转混合5s。
(11)加500ul 100%冷乙醇。轻轻的混匀使之成为均一溶液。2000rpm离心5min。弃去上清液。
(12)用1ml室温70%乙醇清洗Pellet。2000rpm离心5min。用微量移液器尽可能移去上清液,切勿打乱Pellet。
(13)真空干燥Pellet。此步骤应在大约5min完成。不能过干,以免DNA变难于再溶解。
(14)加200ul 1×TE混合, 56℃孵育过夜。次晨,旋涡振荡10s。
2. 盐析法
2.1 原 理
无机盐提取法是用醋酸钠通过盐析原理去除非核酸物质,主要用于血液或血痕、精液或精斑、毛发样本,其优点是提取DNA回收率高,DNA质量也好于Chelex100法。
2.2 仪器设备与试剂
2.2.1 仪器设备:
微型高速离心机,速度13000rpm
37℃、56℃干热器:96孔×4,可调温度5℃~100℃
移液器:10ul、100ul、1000ul可调移液器,误差小于1ul
2.2.2 试剂
细胞裂解缓冲液(CLB):蔗糖,MgCl2,TritonX-100
蛋白裂解缓冲液(PLB):EDTA-2Na,NaCl
20%SDS:SDS,H2O
蛋白酶K:(20mg/ml)
1×TE
70%和100%乙醇
平衡盐缓冲液
一、外周静脉血DNA提取
(一)目的与要求
1、 了解外周静脉血DNA提取的常见方法及其原理
2、 掌握法医学上常用的chelex100法及其原理,并能熟练操作。
(二)常见方法
目前基因组DNA的提取方法较多,如酚/氯仿、尿素提取法、氯化锌法、三乙醇月桂基硫酸盐法、碘化物法、直接煮沸法等等。
样本:人外周静脉抗凝血。分别采集外周静脉血5ml,2%乙二胺四乙酸二钠(EDTA)抗凝待用(要求采血至分离白细胞之间隔时间在室温下放置不超过2h,4℃放置不超过5h,以防白细胞自溶)。
1. 酚/氯仿/异戊醇法
1.1原 理:
通过酚-氯仿混合物萃取DNA溶液中的蛋白质类有机物质,而保留DNA于水相溶液中。适用所有生物检材,其提取DNA量比Chelex法和无机盐提取法多,且 DNA分子结构完整,特别适合RFLP、测序等需要大分子DNA分析技术。
1.2 仪器设备与试剂
1.2.1 仪器设备:
微型高速离心机:可使用1.5ml离心管,最高转速13000r/min
56℃干热器:5~100℃可调,误差小于1℃
移液器:10ul、100ul、1000ul可调移液器,误差小于1ul
1.2.2 试剂:
1×SSC
0.2和2mol/L醋酸钠
10%SDS
蛋白酶K:(20mg/ml)
酚:氯仿:异戊醇(25:24:1)
1×TE
70%和100%乙醇
1.3 步 骤:
(1) 采集血样放入含有EDTA真空管,用前充分混匀。取1.5ml带盖微型离心管吸700ml血样冷冻保存备用。
(2) 37℃培育冷冻血样,加1×SSC 800ul混合。离心,13000rpm,1min,弃上清。
(3) 加1.0ml 1×SSC振荡,离心,13000rpm,1min,弃上清。注意避免触动沉淀物形成的团(Pellet)。
(4) 加375ul 0.2mol/L醋酸钠,振荡使沉淀物悬浮,加10%SDS 25ul和蛋白酶K 5ul,旋涡振荡,56℃培育1h
(5) 加等体积的酚/氯仿/异戊醇,旋涡振荡30s。
(6) 在微型离心机上2000rpm,离心2min。
(7) 仔细吸取水相转移到另一新的1.5ml微型离心管。注意避免吸到在分界面上积聚的变性蛋白,弃去剩余酚和变性蛋白。
(9) 加1ul 100% 冷乙醇,倒转混匀,置于-20℃冰箱15min。
(10)加180ul 1×TE,旋涡振荡使Pellet散开, 56℃孵育10min。加入20ul 2mol/L醋酸钠,倒转混合5s。
(11)加500ul 100%冷乙醇。轻轻的混匀使之成为均一溶液。2000rpm离心5min。弃去上清液。
(12)用1ml室温70%乙醇清洗Pellet。2000rpm离心5min。用微量移液器尽可能移去上清液,切勿打乱Pellet。
(13)真空干燥Pellet。此步骤应在大约5min完成。不能过干,以免DNA变难于再溶解。
(14)加200ul 1×TE混合, 56℃孵育过夜。次晨,旋涡振荡10s。
2. 盐析法
2.1 原 理
无机盐提取法是用醋酸钠通过盐析原理去除非核酸物质,主要用于血液或血痕、精液或精斑、毛发样本,其优点是提取DNA回收率高,DNA质量也好于Chelex100法。
2.2 仪器设备与试剂
2.2.1 仪器设备:
微型高速离心机,速度13000rpm
37℃、56℃干热器:96孔×4,可调温度5℃~100℃
移液器:10ul、100ul、1000ul可调移液器,误差小于1ul
2.2.2 试剂
细胞裂解缓冲液(CLB):蔗糖,MgCl2,TritonX-100
蛋白裂解缓冲液(PLB):EDTA-2Na,NaCl
20%SDS:SDS,H2O
蛋白酶K:(20mg/ml)
1×TE
70%和100%乙醇
平衡盐缓冲液
2.3 步 骤:
(1)吸取400ul细胞裂解液至1.5ml离心管中,加入100ul全血。加盖后倒转混匀1min。保证细胞裂解缓冲液与全血充分混匀,使细胞膜完全破裂。 (2)在微型高速离心机上13000rpm 离心1min,弃去上清液,回收细胞核。
(3)在旋涡振动器上,利用残留少许上清液,振动使细胞核团块散开,成为悬浮液。
(4)加入100ul蛋白裂解液,充分混合,在微型高速离心机上12000rpm 离心1min,弃去上清液。将离心管倒置于滤纸上,吸干残留的上清液。
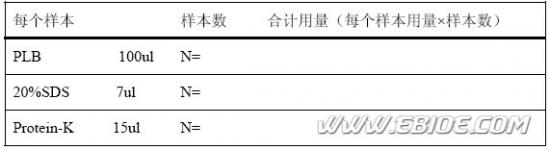
(5)快速加入事先准备好的消化反应液(按下表准备)。全部样本按下表计算:
(6)在微型高速离心机离心10s,在干热器100℃ 8min。>
(7)在微型高速离心机12000 r/min离心2min。DNA存在上清液中,可直接用于PCR扩增反应,推荐用量在25ulPCR反应体系中吸取样本DNA量2.5ul。
3. CHELEX-100法
3.1 原 理
chelex-100是由苯乙烯与二乙烯基苯的共聚体组成的一种螯合树脂,它对多价金属离子有高亲和力,其亚氨基二乙酸侧链起着螯合金属离子作用。现已证实chelex可以防止DNA在煮沸中的降解,并在高温低离子强度下起着催化DNA释放的作用。
Chelex-100能有效除去非核酸有机物,主要用于提取全血或血痕、精液或精斑、混合斑、毛发、培养细胞等。但因生物样本来源不同其操作方法有所差异。
法医学上多使用该法,因其简便,快速,损失少,微量,10~50ul全血就可以提取到适合分析的DNA,适合法医使用。
3.2仪器设备与试剂
3.2.1 仪器设备:
微型离心机
振荡器
水浴锅
微量可调移液器
3.2.2 试剂:
灭菌去离子水
TE缓冲液
5%Chelex储备液(室温保存):
chelex颗粒 5g
灭菌去离子水 100ml
1M NaOH调节pH值至9-11
3.3 步 骤
(1)吸取1ml TE缓冲液加到1.5ml的灭菌离心管内;加入40μl的全血(用量过大时可能会抑制PCR反应)
(2)室温放置15-30分钟,间歇颠倒震荡或轻微漩涡震荡 。
(3)将样本置于离心管中室温10000-15000g(最大速度)离心2-3分钟。
(4)小心且尽可能多地弃去上清 ,保留量不超过20μl在管中,若样本是血斑时保留管底呈团状的载体。
(5)加入5%Chelex至终体积为200ul,短暂涡流震荡混匀。
(6)56℃保温15-30分钟
(7)剧烈漩涡震荡样本5-10秒。
(8)沸水中样本煮8分钟。可用悬浮架。
(9)涡流剧烈震荡5-10秒。
(10)将离心管内的样本在室温条件下以10000-15000g(最大速度)离心2-3分钟后,样本可以进行DNA定量和DNA扩增。
(11)在2-6℃ 或15-25℃条件下保存样本,重新使用时在室温中解冻并重复步骤10-11。
所取全血量和最终DNA含量之间关系: 全血(ul) 理论DNA产量(ug) 1 0.04~0.06 10 0.2~0.4 100 2~4 200 4~6 400 8~10
二、PCR扩增靶DNA
(一)原理
PCR技术的基本原理类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。PCR由变性--退火--延伸三个基本反应步骤构成:
①模板DNA的变性:模板DNA经加热至93℃左右一定时间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应作准备;
②模板DNA与引物的退火(复性):模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA单链的互补序列配对结合;
③引物的延伸:DNA模板--引物结合物在TaqDNA聚合酶的作用下,以dNTP为反应原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条新的与模板DNA 链互补的半保留复制链重复循环变性--退火--延伸三过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。每完成一个循环需2~4分钟, 2~3小时就能将待扩目的基因扩增放大几百万倍。
(二)PCR反应体系与反应条件:
标准的PCR反应体系:
10×扩增缓冲液 10 μl
4种dNTP混合物 各200umol/L
引物 各10~100pmol
模板DNA 0.1~2ug
Taq DNA聚合酶 2.5u
Mg2+ 1.5mmol/L
加双或三蒸水至 100 μl
本试验室的PCR反应体系:
10×扩增缓冲液 3.75 μl
4种dNTP混合物(各200umol/L)6μl
引物 (50pmol/L) 各0.3 μl
模板DNA 2.5~3μl
Taq DNA聚合酶 0.3μl
Mg2+ 2.25μl
加三蒸水至 37.5 μl
PCR反应五要素:参加PCR反应的物质主要有五种即引物、酶、dNTP、模板和Mg2+
(三)仪器设备与试剂
1. 仪器设备:
PCR扩增仪,旋涡震荡器,高速离心机,0.5~10μl、10~100μl、100~1000μl连续可调移液器,移液器吸嘴,0.1ml、0.75ml、1.5mlEP管。
2. 试剂:
10×扩增缓冲、dNTP混合物 、引物 、Taq DNA聚合酶 、 Mg2+、三蒸水(pH为8.0)。
(四) 操作方法
1. 启动PCR扩增仪,设置程序并确定扩增条件,扩增仪的使用方法参见实验室的《PCR扩增仪操作指南》(此步操作也可在“扩增管内容物配制”后进行)。
2. 扩增管内容物配制 用清洁的镊子取用已消毒的EP管并用记号笔编号,用移液器将PCR反应的各种物质加入EP管。(每管含量见上述本实验室所用的37.5μl体系标准)。
3. 将扩增管置于PCR扩增仪上(不带热盖的PCR仪需加矿物有避免液体蒸发),开始扩增程序。结束反应后,PCR产物放置于4℃待电泳检测或-20℃长期保存。
[注意事项] (1)PCR反应应该在专用的PCR实验室且没有DNA污染的干净环境中进行。 (2)所有试剂都应该没有核酸和核酸酶的污染。操作过程中均应戴手套。 (3)试剂或样品准备过程中都要使用一次性灭菌的EP管,玻璃器皿应洗涤干净并高压灭菌。
(4)PCR扩增内容物的配置最好在冰浴上进行,并且要充分混匀。配置过程中尽量减少酶在常温下的放置时间。
(5)连续可调移液器的使用:a.使用时应按照其使用说明进行;b.提样室、扩增室、电泳室的连续可调移液器为专用,不得混淆使用;c.吸取样品时轻按下第一档缓慢吸取,注射时按第二档;d.连续可调移液器为精密仪器,使用时不可用力过猛;e.使用连续可调移液器时应谨防污染,用后及时放于架上。
三 扩增产物的鉴定
PCR扩增产物可以通过酶切分析、凝胶电泳(琼脂糖电泳、聚丙烯酰胺电泳、毛细管电泳等 )、Southern杂交、克隆、测序等方法分析,电泳前还可以应用紫外分光光度计定量DNA。当采用凝胶电泳时也有溴化乙锭显色、银染法、荧光显色等不同的显色方法。
本实验室采用的是非变性连续缓冲系统聚丙烯酰胺凝胶垂直电泳及硝酸银显色分型方法
(一) 原理
生物大分子如蛋白质、核酸、多糖等常以颗粒分散在溶液中.它们的净电荷取决于介质的H+浓度或与其他大分子的相互作用。在电场中,带电颗粒向阴极或阳极迁移.迁移的方向取决于它们带电的符号.这种迁移现象即谓电泳。迁移的方式目前可以根据分子尺寸大小、分子所带的电荷或分子的生物学与化学特性分为三类。如果把生物大分子的胶体溶液放在一个没有干扰的电场中,使颗粒具有一定迁移速率的驱动力来自于颗粒的有效电荷Q和电位梯度E。它们与介质的摩擦阻力f抗衡:在自由溶液中,这种抗衡服从斯托克斯定律。f=6πrvη 这里v是在介质粘度为η半径为r的颗粒的移动速度。但在凝胶中,这种抗衡并不完全符合斯
托克斯定律。f还取决于介质小的其他因子,如凝胶厚度、颗粒尺寸、甚至介质的内渗率等。简言之电泳就是带电颗粒在电场中定向移动。
银染显色的原理是用甲醛将沉积在DNA带上的银离子(硝酸银)还原成金属银而显带。
(二)仪器设备与试剂
1. 仪器设备:
垂直电泳仪、垂直电泳槽、玻璃、橡胶模框、点样梳、摇床、微量进样器、染色托盘。
2. 试剂:
聚丙烯酰胺(C=30% T=5%) :丙烯酰胺 28.5g 、 N,N’-二甲基双丙烯酰胺 1.5g、DDH2O 100ml;7%聚丙烯酰胺:30%聚丙烯酰胺 23.3ml、10ml 10×TBE溶液、66.7ml DDH2O ;10×TBE溶液:Tris 113g 、硼酸 55g、 1000ml DDH2O ;1×TBE溶液:10×TBE溶液100ml,900ml DDH2O;10%乙醇;0.1%硝酸;0.2%AgNO3:AgNO3 0.15g、DH2O 225ml;30%NaCO3-甲醛:NaCO3 30g、甲醛 0.85ml;0.1% AgNO3:AgNO3 1g、1000ml DH2O;上样缓冲液:0.25%二甲苯氰蓝、0.25% 溴酚蓝;TEMED;10%过硫酸胺:过硫酸胺1g、10ml DDH2O。
(三)操作
1. 电泳槽玻璃板的处理:用洗涤剂清洗玻璃板,自来水反复冲净洗涤剂,双蒸水冲洗3次,烘干,将两块玻璃装入恰当德橡胶模框内,并组装好电泳槽(带长玻璃的贮液槽为正极,带短玻璃的贮液槽为阴极)。
2. 制胶:加 35μl TEMED和300μl2.5%过硫酸胺至7%聚丙烯酰胺溶液中混匀。以60O角,缓慢注入两玻璃板间的空隙中,直至灌满模具顶部。立即插入相应的点样梳,(小心勿使梳齿下带进气泡,并且不要将梳齿全部插入胶内,留约2mm梳齿于玻璃板上端,以免拔梳时把胶孔拔断)。由于凝胶在聚合过程中有回缩,所以应小心添加些胶液于梳子处,水平放置,室温聚合1小时。向电泳槽内灌入 1×TBE电泳缓冲液。小心取出点样梳,用槽内的缓冲液反复冲洗点样孔,以去除可能存在的未聚合的聚丙烯酸胺和气泡。
3. 加样:取2-4μl扩增产物和2μl上样缓冲液混匀,用微量进样器小心加入样品槽中。若DNA含量偏低,则可适当增加上样量,但总体积不可超过样品槽容量。
4. 电泳:电泳槽接上电极开启电源,根据扩增片段的大小及电泳槽和凝胶的大小,决定电泳的电压及电泳时间。通常室温下以l~5V/cm电泳。当溴酚蓝条带移动到距凝胶前沿约2cm时,停止电泳。
5. 银染法显色:
方法一:a. 将PAG板浸入10%乙醇溶液固定10min,用纯水洗一次;
b. 0.1%硝酸3min,蒸馏水洗两次。
C. 0.2% AgNO3溶液中10min,用去离子水洗三次;
d. 用30% NaCO3-甲醛溶液显色至满意为止,用适量10%冰乙酸终止显色。
方法二:a. 取下凝胶,蒸馏水清洗凝胶30秒。 b. 0.1% 硝酸银染色10分钟。 c. 弃去染色液,蒸馏水洗胶两次。 d. 显色液(显色液配方: 10g NaOH + 0.2g Na2CO3 + 2ml甲醛溶液,定溶到 500ml)显色至满意为止。
6. 分型:参照基因阶梯的电泳谱带进行分型。
[注意事项]
(1)每加完一个样品要清洗微量进样器,以防止互相污染,注意上样时要小心操作,避免损坏凝胶或将样品槽底部凝胶刺穿。
(2) 以二甲苯氰蓝和溴酚蓝的位置大致判断泳动距离,7%聚丙烯酰胺非变性胶中溴酚蓝相当于170bp的泳动距离,二甲苯氰蓝相当于40bp的泳动距离。
(3)银染时显色液配制好在4-10 ℃预冷可以减轻胶板的底色,银染后胶板在水中漂洗时间控制在10s以内。