欧美市场上目前共有200多个重组蛋白药物,包括凝血因子、激素、生长因子、细胞因子、酶和抗体等。大部分蛋白药物与天然蛋白的结构相同或者相似,半衰期也与天然蛋白相似。长效化蛋白制剂并非首创新药,却是Biobetter的重要实现途径,通过长效化可以提高患者的顺应性,改善患者自我疾病管理。正如化药常用的微球缓释技术,融合蛋白是蛋白药物biobetter最为重要的实现手段。
蛋白药物长效化的实现策略包括糖基化改造、聚乙二醇化、白蛋白融合、转铁蛋白融合、Fc融合等,其中PEG化是通过增加水力半径延长半衰期,白蛋白融合、转铁蛋白融合和Fc融合则通过FcRn介导的循环途径和增加分子大小来延长半衰期。其他方式还包括惰性蛋白融合如XTEN融合、HAP融合、ELP融合等,以及负电蛋白融合如CTP融合等。
已上市长效化蛋白/融合蛋白药物
欧美市场已经上市了13个Fc融合蛋白药物、12个PEG化蛋白药物、2个白蛋白融合蛋白药物、2个糖基化改造蛋白药物、1个CTP融合蛋白药物。具体药品见下表:
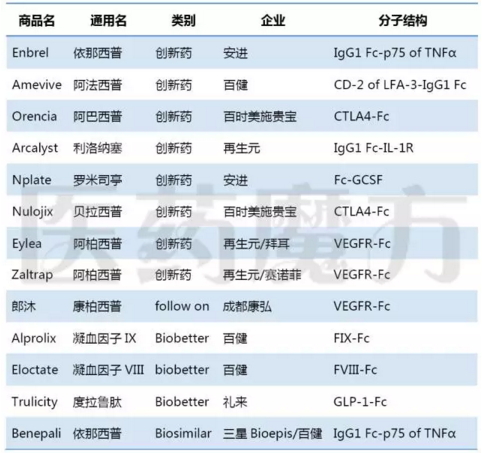
已上市的13个Fc融合蛋白药物
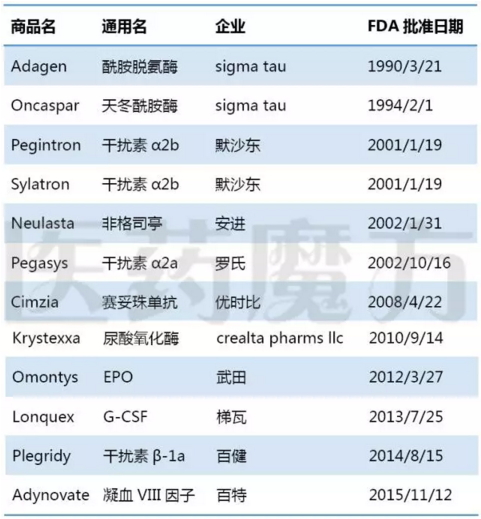
已上市的12个PEG化蛋白药物
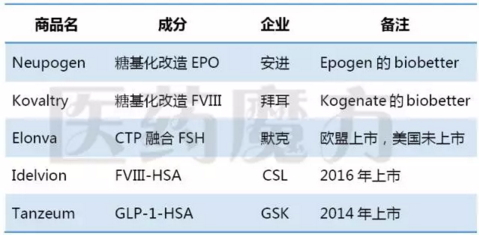
其他已上市长效化蛋白药物
Fc融合蛋白的技术较为成熟,Alprolix、Eloctate、Trulicity是基于Fc技术的biobetter药物,延长了VIII因子、IX因子、GLP-1的半衰期,减少了给药频率。已上市的Fc融合蛋白药物见下表。
在研的长效化蛋白药物
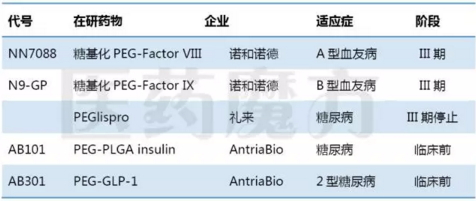
PEG化虽然也被FDA作为GRAS(generally recognized as safe,通常认为是安全的)的方法,但是有研究显示PEG成分与肾小管上皮细胞空心化有关,存在潜在的风险。融合蛋白成为开发长效化蛋白药物的主要方法
PEG化蛋白药物
基于Fc或IgG的融合蛋白
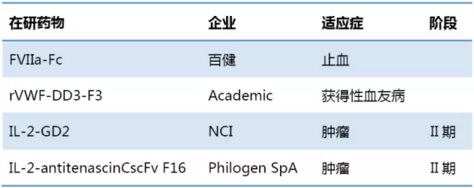
近年来多种融合蛋白技术平台应用于biobetter开发,陆续推进临床研究。
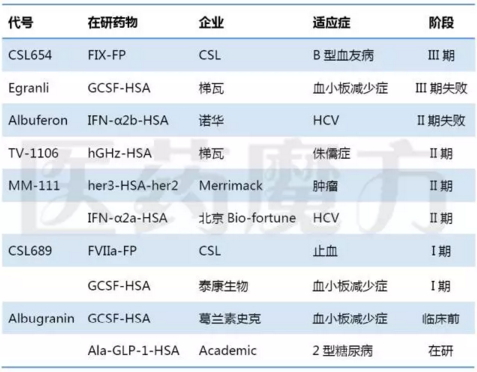
白蛋白融合技术最早在90年代由CSL开发。2000年Human Genome Sciences(HGS)公司收购了从CSL中拆分出来的Principia,2012年HGS又被GSK收购。目前,白蛋白融合技术领先的公司主要是GSK、Teva(收购了另一家从HGS独立出来的公司)、Cogenesis和CSL这四家药企。GSK开发的GLP-1-HSA产品Tanzeum已经在欧美上市,给药频率为每周1次。CSL开发的FVIII-HSA产品Idelvion于2016年1月获批上市。
白蛋白融合蛋白药物
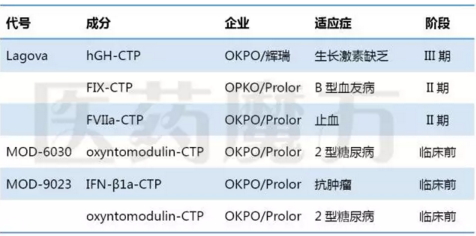
CTP融合蛋白技术由Prolor Biotech最早开发,2013年该公司被OPKO收购。该技术被应用于多个蛋白药物,进展最快的为生长激素CTP融合蛋白,目前和辉瑞合作开发,处于III期临床阶段。
CTP融合蛋白药物
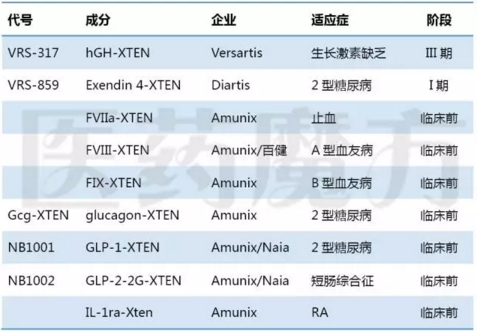
XTEN融合蛋白技术由Amunix开发,目前被用于9个融合蛋白药物开发。其中生长激素XTEN融合蛋白处于III期临床研究阶段,半衰期延长到131h,明显高于天然生长激素。艾塞那肽融合XTEN后,猴子体内试验证实半衰期从30min提高到60h。
XTEN融合蛋白药物
ELP融合蛋白技术由PhaseBio公司开发,主要用于胰岛素和GLP-1长效化制剂的开发,目前处于II期临床研究阶段,给药频率为每周1次。
ELP融合蛋白药物

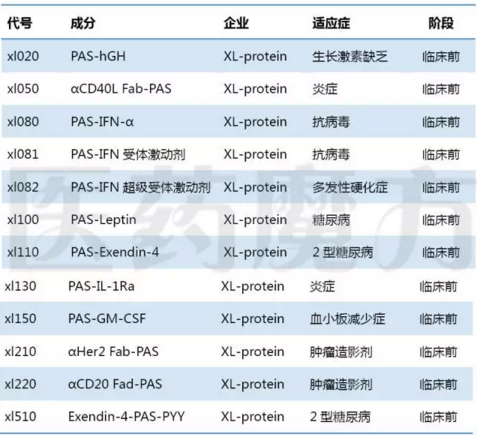
PAS融合蛋白技术由XL-protein公司开发,由100-200个重复PAS三肽组成,老鼠体内试验可以延长半衰期3~6倍。目前有15个应用该技术的融合蛋白药物处于临床前阶段。
PAS融合蛋白药物
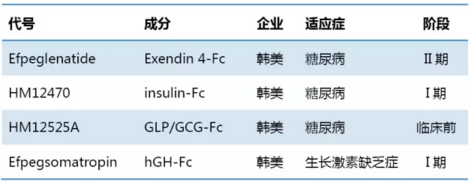
LAPS技术(即Fc修饰蛋白技术)由韩美公司开发,不同于Fc融合蛋白技术,Fc部分由大肠杆菌发酵表达,与目标蛋白经化学偶联完成。2015年,韩美以44亿美元授权给赛诺菲的产品即为应用该平台的GLP-1和胰岛素项目。目前GLP-1 LAPS处于II期临床阶段,胰岛素-LAPS处于I期临床研究阶段。

Fc修饰蛋白药物(非融合蛋白,体外化学连接)
结语
生物药物不同于化学药,多为天然蛋白分子,不存在专利障碍,因此可以利用长效化技术平台开发新药或者biobetter药物,既节省开发成本也有一定的市场空间。
虽然融合蛋白等技术会有活性变化、免疫原性提高、稳定性等潜在风险,但从目前的发展来看,风险较小。以免疫原性为例,CTP融合蛋白药物Elonva只有0.2%患者产生了抗药抗体,ELP融合蛋白药物Glymera只有不到4%的患者产生了抗药抗体,白蛋白融合药物Tanzeum只有不到5%的患者产生了抗药抗体。在这几个药物中,均未产生中和性抗体。虽然有待继续验证,但目前来看多个融合蛋白技术都表现出了非常好的安全性。
融合蛋白技术尤其适用于国内企业,不同于欧美国家biobetter开发多于biosimilar,国内的biobetter开发远少于biosimilar药物。通过专注技术平台,仿效韩国企业,开发biobetter药物,或许是避免陷入biosimilar恶性竞争的另一条出路。







