从生物类似药专利到期时间角度分析,我们发现,2014-2020年将是生物类似药尤其是抗体(含肿瘤坏死因子受体抗体)发展的黄金时段,未来会有更多生物类似药期待获批。
表2-1全球主要生物药概况及专利到期时间
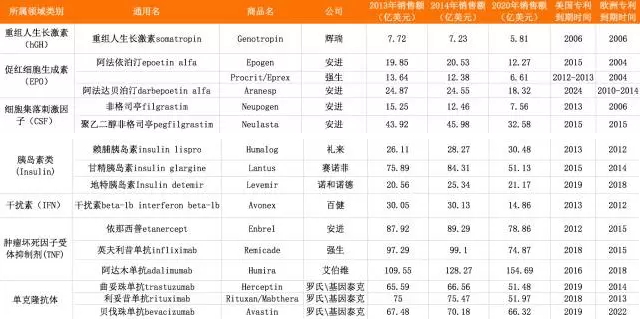
(来源:汤森路透Cortellis 竞争情报数据库,2015-06-09)
从目前全球公司对于主要国家地区生物药布局的数量上来看,拥有生物药研发管线最多的国家是美国,中国位居第二。但是,拥有生物类似药研发管线数量最多的国家是中国。
图2-1生物药研发数量较多的国家
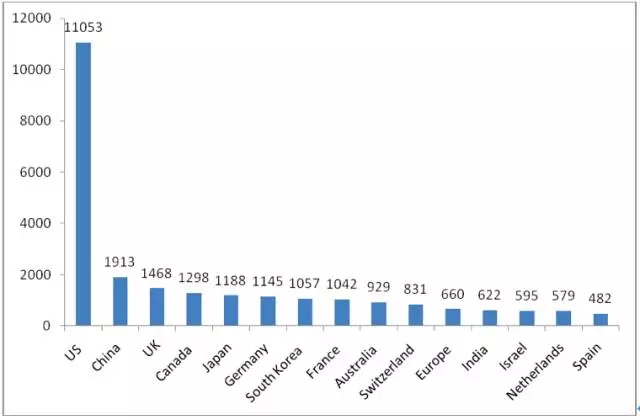
(来源:汤森路透Cortellis 竞争情报数据库,2015-11-09)
图3-1生物类似药研发分布的主要国家
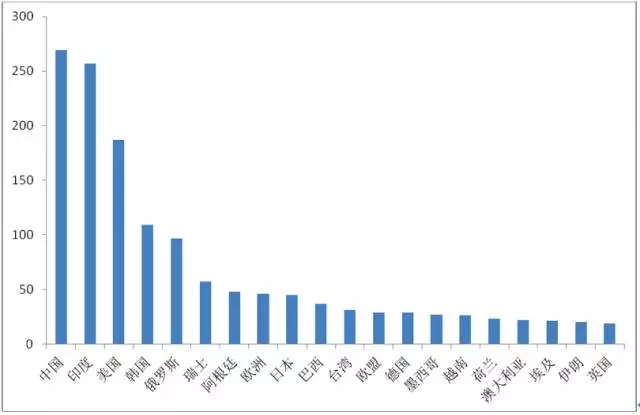
(来源:汤森路透Cortellis 竞争情报数据库,2015-11-09)
从治疗领域分析,目前生物类似药的研发主要集中于血液病、肿瘤、免疫等领域。
图2-3生物类似药主要集中的疾病领域
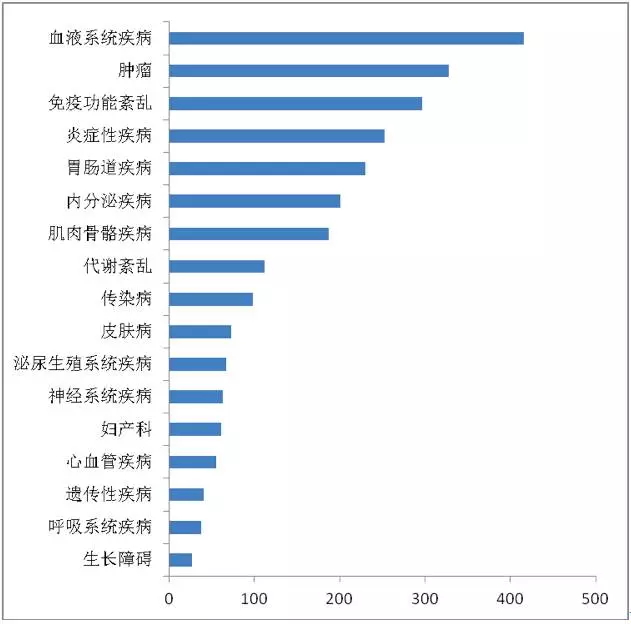
(来源:汤森路透Cortellis 竞争情报数据库,2015-11-09)
目前,在汤森路透Cortellis 竞争情报数据库的研发管线中,约有270个生物类似药在中国有研发状态,约有一半处于临床前研究阶段,其中有65个提交临床申请(大部分是在2014年以后提交临床申请),10个已经获得临床批件,有望于近期开展临床试验。
图3-2中国生物类似药研发阶段比较
(来源:汤森路透Cortellis 竞争情报数据库,2015-11-09)
单克隆抗体包括肿瘤坏死因子受体抗体发展潜力巨大,已经成为中国许多企业竞争的主要领域,约占整个生物类似药总量的50%。目前,中国单克隆抗体处于发展初期,大部分处于临床前研发阶段,只有19个单抗产品上市,其中进口产品11个,国产品种8个。
图3-3中国生物类仿制药类别的比较
(来源:汤森路透Cortellis 竞争情报数据库,2015-11-09)
随着留学归国人员的回归,VC的介入,生产技术的发展以及国家政策的影响,中国许多公司开始涉足生物类似药领域。其中不乏有如齐鲁制药、浙江海正药业、双鹭药业这样的老牌公司,也有如苏州康宁杰瑞、上海复旦张江生物医药有限公司这样的新秀。
图3-4拥有5个以上生物类似药的公司
(来源:汤森路透Cortellis 竞争情报数据库,2015-11-09)
在中国关于生物类似药的交易中,药物研发及商业许可的交易类型占比最高,有23项。
虽然中国生物类似药的发展潜力巨大,但其在研发和生产中仍面临诸多挑战。而政府除了指导原则之外,也需要进一步出台相关细则以其促进生物类似药产业的快速发展。
该报告将于12月1-2日的第二届生物医药创新发展峰会(Biolink)上发布,并由汤森路透解决方案专家周峰博士就报告进行现场分析解读,同时为所有参会嘉宾免费提供全文印刷本。







