当小偷进入银行金库,传感器被激活,警报器会报警。细胞对“入侵物”具有独自的早期预警系统,来自法国格勒诺布尔欧洲分子生物学实验室(EMBL)的研究人员发现了一种特殊蛋白质如何发出警报,当它检测到入侵病毒时。这项研究发表在10月14日《Cell》期刊上,是认识先天性免疫应答的核心部分,并揭示了细胞如何快速地应对广泛的病毒,如流感、狂犬病毒和肝炎病毒。
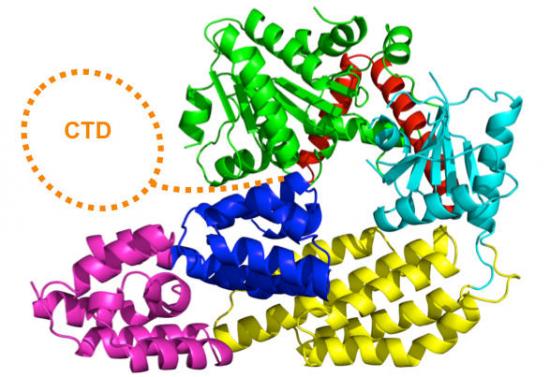
当发现“入侵物”,一种特殊蛋白质会发出警报
为了感知“入侵物”,细胞利用一种称为模式识别受体的蛋白质,它们能识别并结合在“入侵者”仅有的分子标签上。结合后这些受体能改变形状,并启动链式反应,最终提醒周围细胞应对“入侵物”。然而,至今还不知道两个过程—感知和信号的连接方式。EMBL的科学家已经发现了精确的结构机制,通过这一机制RIG-I(其中一个受体)把改变的结构转变成信号。
研究的负责人Stephen Cusack称,对于结构生物学家来说,配体结合受体后如何诱发信号?这是一个经典问题。我们尤其钟情于用RIG-I回答这一问题,因为RIG-I能靶定几乎所用的RNA病毒,如流感病毒、麻疹病毒和丙型肝炎病毒。
在病毒感染的应答中,RIG-I识别病毒的遗传物质(具体来说是病毒RNA),并激活细胞合成关键的抗病毒分子—干扰素。干扰素分泌后被周围细胞接受,引起它们表达数百个抗感染基因。为了理解RIG-I如何仅感知病毒RNA(而非细胞自身的RNA)并发出警报,科学家利用X射线晶体成像技术确定了分别在有无病毒RNA时RIG-I的3维原子结构。
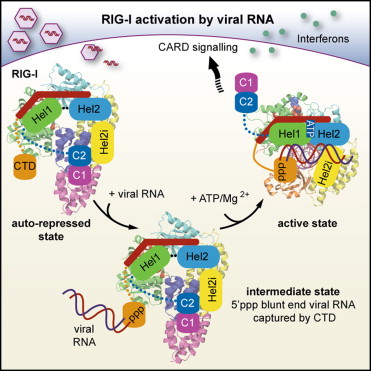
RIG-I受病毒RNA激活途径
他们发现,没有病毒感染时受体处于“睁一只眼睡眠”,能感知病毒RNA的RIG-I结构域暴露在外面,而信号功能域被隐藏,不能触及信号体系。当检测到病毒RNA时,RIG-I会改变形状,“苏醒”的信号功能域激发干扰素的合成。尽管EMBL的科学家使用野鸭的RIG-I分子,但是,这一受体与人类的相同受体在行为方面保持一致。
操作绝大多数实验的Eva Kowalinski博士称,RIG-I在病毒RNA应答过程中被激活,但类似的机制很可能出现在其它的免疫受体上,不管它们针对病毒或是病菌。
因此,这项研究有助于拓宽对先天性免疫系统功能的理解,其是人体对“入侵物”的第一道防线,并与今年的诺贝尔生理学或医学奖主题有关。(生物探索译 Pobee)
相关英文论文摘要:
Structural Basis for the Activation of Innate Immune Pattern-Recognition Receptor RIG-I by Viral RNA
RIG-I is a key innate immune pattern-recognition receptor that triggers interferon expression upon detection of intracellular 5′triphosphate double-stranded RNA (5′ppp-dsRNA) of viral origin. RIG-I comprises N-terminal caspase activation and recruitment domains (CARDs), a DECH helicase, and a C-terminal domain (CTD). We present crystal structures of the ligand-free, autorepressed, and RNA-bound, activated states of RIG-I. Inactive RIG-I has an open conformation with the CARDs sequestered by a helical domain inserted between the two helicase moieties. ATP and dsRNA binding induce a major rearrangement to a closed conformation in which the helicase and CTD bind the blunt end 5′ppp-dsRNA with perfect complementarity but incompatibly with continued CARD binding. We propose that after initial binding of 5′ppp-dsRNA to the flexibly linked CTD, co-operative tight binding of ATP and RNA to the helicase domain liberates the CARDs for downstream signaling. These findings significantly advance our molecular understanding of the activation of innate immune signaling helicases.
英文论文链接:https://www.cell.com/abstract/S0092-8674%2811%2901150-0







