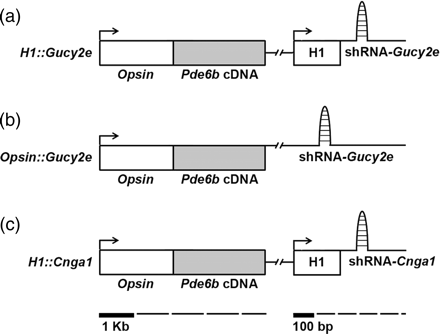
1. Schematic representation of the lentiviral vectors.
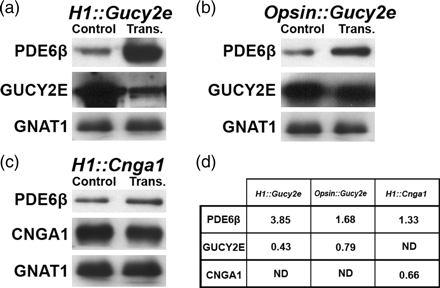
2. Immunoblotting analysis of retinal lysates from C57BL/6J mice transduced with bipartite vectors.
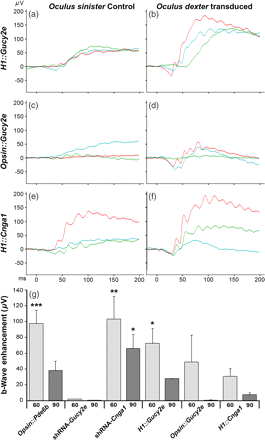
3. Functional rescue due to bipartite vector transduction.
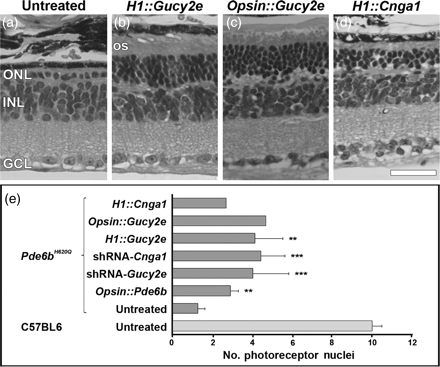
4. Photoreceptor cell rescue due to bipartite vector transduction.
在2011年10月发表于《实验生物与医学》期刊的文章中,由 Stephen H Tsang博士所领导的哥伦比亚大学医学中心研究团队报导了藉由双重基因疗法可于色素性视网膜炎老鼠动物模式中达到光受器的暂时性功能保留。
色素性视网膜炎为一异质性疾病,特征为渐进性的杆状光受器退化所造成的夜盲症以及最终所造成的全盲。于全世界约有三万六千个因简单性及家族性磷酸双酯分解酵素(PDE6)突变所造成色素性视网膜炎的病例。由Victor McKusick所编写的《人类孟德尔遗传学》列出了约四千个基因性的疾病,但目前只有其中的四个可以用基因疗法治愈。藉由具有细胞特异性的递送正常基因以及用来降低讯息传递路径中其他基因表现的小发夹核糖核酸,此一双重基因疗法指出了一个可应用于更多视网膜退化性疾病的治疗策略。杆状光受器的退化亦影响到约九万个患有老化性黄斑部退化的美国人。用于色素性视网膜炎老鼠动物模式中保存光受器的治疗策略亦具有应用于此一疾病的可行性。
虽然具有高盛行率,但对于磷酸双酯代谢性缺失与色素性视网膜炎致病因素的关连性的了解还十分的有限。在许多的色素性视网膜炎老鼠动物模式中,可以观察到磷酸双酯分解酵素(PDE6B)缺失会导致讯息传递分子环磷酸鸟苷(经由GUCY2E环化酵素所调节)与钙离子(经由CNGA1通道所调节)的增加。
在此一发表于《实验生物与医学》报导中,有许多方面是十分创新的。它解决的磷酸双酯分解酵素功能上的缺失(藉由基因置换促进功能),并藉由降低环磷酸鸟苷与钙离子的浓度来减缓此一功能性缺失在生物化学功能上所造成的影响。此外,该研究团队藉由细胞特异性的启动子来达成具有细胞特异性的转殖基因表现,这在小发夹核糖核酸的递送上是一项十分具有创新性的作法。
哥伦比亚大学的研究团队发展了三个腺病毒载体,分别用于递送磷酸双酯分解酵素以及另两个小发夹核糖核酸。其一用于递送磷酸双酯分解酵素基因以及针对GUCY2E基因的小发夹核糖核酸用以降低降低环磷酸鸟苷的浓度;其二用于递送磷酸双酯分解酵素基因以及针对CNGA1基因的小发夹核糖核酸用以降低降低钙离子的浓度;其三用于递送磷酸双酯分解酵素基因以及由细胞特异性启动子所驱动的针对GUCY2E基因的小发夹核糖核酸。在Steven Tseng博士研究团队先前的报导中已经证实了此一双重基因疗法比单一基因疗法有更加的疗效。虽然在目前的研究计画中并未有更近一步的发展,研究人员仍乐观的表示,双重基因疗法代表了眼部及其他组织型态相关疾病基因疗法的一个新的发展方向。
在现有的小发夹核糖核酸载体递送系统中,通常藉由核糖核酸合成酵素丙的启动子来驱动转职基因的表现,然而该基因在所有型态的细胞中皆有表现。因此,如果在柱状光受器细胞中﹙传递彩色视觉﹚中表现针对GUCY2E基因的小发夹核糖核酸会对视觉造成相当严重的副作用。为了达成杆状细胞特异性的小发夹核糖核酸表现,研究人员将小发夹核糖核酸置于前微核糖核酸-34(该基因只在杆状细胞中表现)的核糖核酸合成酵素乙转录单元中。类似的方法可应用于其他型态的不同组织,此一方法具有相当广泛的应用性。
于Pde6bH620Q老鼠动物模式中测试小发夹核糖核酸的疗效将有助于临床前色素性视网膜炎的疗效评估。可预期地,在发展可行的之前人体疗法之前,研究的成果将被有效的转译至磷酸双酯分解酵素缺失的大型动物模式﹙如:爱尔兰雪达犬﹚当中。
《实验生物与医学》期刊主编Steve Goodman博士表示,哥伦比亚大学医学中心由 Stephen H Tsang博士所领导的研究团队在色素性视网膜炎老鼠动物模式中应用的一个十分特殊的基因疗法来保留光受器及延长视觉功能。此一成果为未来的色素性视网膜炎基因疗法提供了一个发展的希望与荣景。
相关英文原文摘要:
Lentivirus-mediated expression of cDNA and shRNA slows degeneration in retinitis pigmentosa
Mutations in Pde6b lead to high levels of signaling molecules cyclic guanosine monophosphate (cGMP) and Ca2+, which ultimately result in photoreceptor cell death in certain forms of retinitis pigmentosa (RP). The level of cGMP, which is controlled by opposing activities of guanylate cyclase (GUCY) and photoreceptor phosphodiesterase-6 (PDE6), regulates the opening of cyclic nucleotide-gated ion channels [CNG] and thereby controls Ca2+ influx into the outer segments. Using a lentiviral gene therapy approach, we have previously shown that degeneration can be temporarily slowed either by introducing wild-type PDE6β or knocking down expression of GUCY2E and CNGA1 in photoreceptors of Pde6bH620Q, a mouse model for RP. Rescue was transient with either approach. Therefore, we tested a novel combination therapy using bipartite lentiviral vectors designed to both introduce wild-type PDE6β expression and knockdown GUCY2E or CNGA1. Immunoblot analysis shows simultaneous increases in PDE6β and decreases in GUCY2E or CNGA1 in retinas transduced by the vectors, indicating successful transduction. In Pde6bH620Q mutants, we observe rescue of photoreceptor function and an increase in photoreceptor rows as compared with untreated controls. However, no evidence of prolonged rescue beyond the limit of the previously tested single therapy was observed.
英文论文全文:https://www.biodiscover.com/news/cell/library/1357.html







