近日来自中国科学院上海有机化学研究所、美国哈佛大学医学院、北卡罗来纳大学教堂山分校的研究人员通过系列实验,揭示了自噬相关蛋白Beclin 1对p53蛋白水平的调控作用和相关分子机制,为进一步深入了解自噬与肿瘤发生之间的关系提供了重要信息。这一研究成果在线发表在9月30日的《细胞》(Cell)杂志上。
来自美国哈佛大学医学院的袁钧英教授和中国科学院上海有机化学研究所马大为研究员为这篇文章的共同通讯作者。袁钧英教授是著名的华人科学家,与施一公,饶毅等齐名。她一直从事细胞死亡的相关研究,2005年发现了一种细胞非调亡性的程序性死亡,英文称为necroptosis,是国际权威之一。她还获得了美国卫生研究所(NIH)颁发了的NIH主任先驱奖(Director's Pioneer Award)。2000年起任哈佛大学医学院终生教授,2004年被复旦大学国家重点实验室管理委员会批准为遗传工程国家重点实验室海外客座教授。
细胞自噬(autophagy)是继细胞凋亡(apoptosis)后,生命科学领域的又一热门研究方向。文献数量在近年来呈爆炸式增长,在2006年以前相关文献大约1500条,而从2007年到2010年9月短短三年文献宣布量即到达大约4400条。自噬是由 Ashford 和 Porter 在 1962 年发现细胞内有“自己吃自己”的现象后提出的,是指从粗面内质网的无核糖体附着区脱落的双层膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬体(autophagosome),并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞本身的代谢需要和某些细胞器的更新的一个分解代谢过程。自噬作为一种进化上非常古老和保守的代谢途径,参与调节细胞物质的合成,降解和重新利用之间的代谢平衡,影响参与到生物生命过程的方方面面。
在细胞自噬研究中,与肿瘤的关系是一大重点。目前不少实验室聚焦于细胞水平和分子水平自噬系统变化与肿瘤发生发展相关性的研究。Beclin 1基因是第一个确认的哺乳动物自噬基因,也是第一个确认在自噬的溶酶体降解途径中起肿瘤抑制作用的基因。有研究报道Beclin 1基因缺陷可导致多种恶性肿瘤的发生,然而科学家们对于其分子信号机制并不是很清楚。
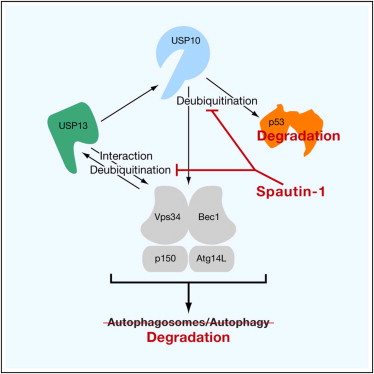
在这篇文章中,研究人员利用高通量筛选技术发现了一种有效的自噬小分子抑制剂spautin-1。他们证实spautin-1可通过抑制泛素特异性肽酶USP10 和USP13对Beclin1的去泛素化作用,促使Beclin 1和Vps34复合物降解,从而抑制细胞发生自噬。随后在更深入的USP10、USP13与Beclin1的相互作用分子机制研究中,研究人员惊奇地发现它们之间并非仅存在USP10 和USP13对Beclin1的去泛素化作用,Beclin1亦可转而影响USP10和USP13的去泛素化活性,从而对p53蛋白水平进行调控。
新研究不仅为我们提供了一个开发抗癌药物的有潜力的先导化合物,同时揭示了联系肿瘤抑制因子p53和自噬相关基因Beclin1的一条重要的分子信号通路,为进一步深入了解自噬与肿瘤发生之间的关系提供了重要信息。
相关英文论文摘要:
Beclin1 Controls the Levels of p53 by Regulating the Deubiquitination Activity of USP10 and USP13
Autophagy is an important intracellular catabolic mechanism that mediates the degradation of cytoplasmic proteins and organelles. We report a potent small molecule inhibitor of autophagy named “spautin-1” for specific and potent autophagy inhibitor-1. Spautin-1 promotes the degradation of Vps34 PI3 kinase complexes by inhibiting two ubiquitin-specific peptidases, USP10 and USP13, that target the Beclin1 subunit of Vps34 complexes. Beclin1 is a tumor suppressor and frequently monoallelically lost in human cancers. Interestingly, Beclin1 also controls the protein stabilities of USP10 and USP13 by regulating their deubiquitinating activities. Since USP10 mediates the deubiquitination of p53, regulating deubiquitination activity of USP10 and USP13 by Beclin1 provides a mechanism for Beclin1 to control the levels of p53. Our study provides a molecular mechanism involving protein deubiquitination that connects two important tumor suppressors, p53 and Beclin1, and a potent small molecule inhibitor of autophagy as a possible lead compound for developing anticancer drugs.







