加拿大渥太华医院研究所、渥太华大学以及其它几个机构在《自然》杂志上报告了一种世界首例癌症治疗方法的治疗效果。他们的试验证明,通过静脉注射释放病毒的方法可以造成肿瘤持续而广泛的感染,且不会伤害人类正常组织。研究还首次证明,通过静脉注射病毒,肿瘤会选择性表达一种外部基因。

渥太华大学医学教授 John Bell博士
研究包括23名(7名来自渥太华医院)已发生多个器官转移、常规治疗无效的晚期癌症患者。这些患者分别接受了5种剂量的病毒JX-594单次静脉注射,并在8~10天后进行了活检。在两个最高剂量组的87%患者中发现了病毒在肿瘤中复制的证据,而正常组织没有发现病毒复制。在所有患者中发现,肿瘤会选择性表达一种通过基因工程插入到病毒中用于帮助探测的外部基因。患者对各种剂量病毒的耐受良好,只有轻、中度的流感症状,持续时间不到一天。
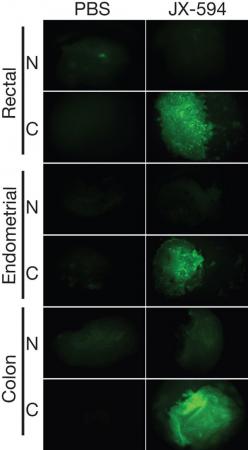
渥太华医院研究所资深科学家约翰•贝尔说,“人类通过静脉注射病毒、使其在癌症组织中持续和有选择性地复制的病毒疗法在医学史上属于首次。相对于直接肿瘤注射的方法来说,静脉注射可以针对全身的肿瘤。这项研究的另一个重要发现是,我们可以通过这种方法让肿瘤有选择地表达外部基因,这就为全新的癌症治疗打开了大门。”
贝尔和他的研究小组在渥太华医院研究所进行了10年多的抗癌病毒(溶瘤病毒)研究。JX-594是与其他合作伙伴共同研究发现的。这种病毒来源于牛痘病毒。牛痘病毒具有选择性地在癌症细胞中复制的能力,但需要通过基因工程来加强它的抗癌特性。
“溶瘤病毒是一种独一无二的病毒,它们可以通过多种途径攻击肿瘤。相对其它疗法来说,这种治疗的副作用很轻微,而且很容易针对不同癌症进行定制。”贝尔说。“在患者身上验证这些病毒还处于早期阶段,但我相信有一天病毒以及其它生物疗法将真正成为癌症治疗的手段。”
尽管这次试验主要目的是评价JX-594的安全和释放,但也对它的抗肿瘤活性作了评估。在两个高剂量组中,75%患者的肿瘤缩小或者稳定,但低剂量组较少有这种表现。
“我们对研究结果是满意的,特别是在只有一次剂量的早期阶段。”贝尔说。“我们还需要进行更多的试验来验证这种病毒能否真正对患者起作用。我们还要进行实验室研究,以提高对这些病毒的认识,并了解如何更好地去利用它们。”
相关英文论文摘要:
Intravenous delivery of a multi-mechanistic cancer-targeted oncolytic poxvirus in humans
The efficacy and safety of biological molecules in cancer therapy, such as peptides and small interfering RNAs (siRNAs), could be markedly increased if high concentrations could be achieved and amplified selectively in tumour tissues versus normal tissues after intravenous administration. This has not been achievable so far in humans. We hypothesized that a poxvirus, which evolved for blood-borne systemic spread in mammals, could be engineered for cancer-selective replication and used as a vehicle for the intravenous delivery and expression of transgenes in tumours. JX-594 is an oncolytic poxvirus engineered for replication, transgene expression and amplification in cancer cells harbouring activation of the epidermal growth factor receptor (EGFR)/Ras pathway, followed by cell lysis and anticancer immunity. Here we show in a clinical trial that JX-594 selectively infects, replicates and expresses transgene products in cancer tissue after intravenous infusion, in a dose-related fashion. Normal tissues were not affected clinically. This platform technology opens up the possibility of multifunctional products that selectively express high concentrations of several complementary therapeutic and imaging molecules in metastatic solid tumours in humans.







