Sip2能通过NuA4乙酰化,导致细胞衰老(图)
来自台湾大学公关卫生学院,约翰霍普金斯医学院,芝加哥大学等处的研究人员发现一种关键激酶的乙酰化能调控细胞衰老,并指出这种调控与营养摄入无关,这对于进一步分析衰老的机制具有重要的意义。这一研究成果公布在Cell杂志上,并登上了头条。
文章的通讯作者分别是来自台湾大学的庄立民(Lee Ming Chuang)教授,约翰霍普金斯医学院的Jef D. Boeke和朱衡(Zhu Heng)副教授。其中朱衡副教授早年毕业于北京大学,获美国克莱姆森大学博士学位,是世界上蛋白质芯片技术的主要创始人之一,生物通曾于09年就蛋白技术采访过他(专访Cell文章作者 解密蛋白技术)。庄立民教授来自台湾大学,主要从事糖尿病、慢性病预防医学研究,这一研究团队主要由华人科学家组成。
组蛋白与非组蛋白的乙酰化是一种重要的翻译后修饰,影响了许多细胞进程。这种可逆的动态过程,能通过多种组蛋白乙酰基转移酶(HATs)和去乙酰基酶(HDAcs)的共同作用,使染色质结构发生动态改变,对基因的转录产生相应的影响。
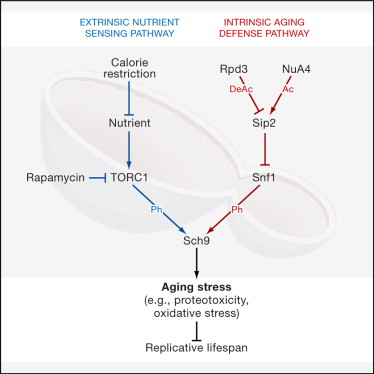
在这篇文章中,研究人员发现腺苷酸活化蛋白激酶(AMPK,AMP-activated protein kinase)中一个亚基:Sip2能通过NuA4乙酰化,并随着细胞衰老,其乙酰化程度降低,从而提出Sip2乙酰化具有抗衰老的作用。
Sip2是Snf1复合物(AMPK)中的一种调控性β亚基,这项研究发现乙酰转移酶,和Rpd3去乙酰化酶能调控Sip2的乙酰化,并且Sip2乙酰化后,能与Snf1更加紧密的结合,增强Snf1复合物的催化活性,Sip2-Snf1的相互作用会抑制Snf1的活性,因而会降低下游靶标:Sch9的磷酸化程度,并最终减缓生长的速度,延长生命周期。
研究人员还通过进一步的实验,证明Sip2的抗衰老作用与营养摄入和TORC1活性无关,从这些研究数据,研究人员提出了一种调控Sch9活性的蛋白乙酰化-磷酸化级联效应,这种效应能调控酵母内源性衰老,延长生命周期,这对于进一步分析衰老的机制具有重要的意义。
除此之外,近期来自哈佛的另外一组华裔研究人员发现了N末端α-乙酰化修饰蛋白对于细胞生存的关键作用,为进一步深入了解细胞凋亡提供了重要信息。
之前的研究证明N末端α-乙酰化修饰蛋白与细胞对凋亡信号的敏感性密切相关,在这篇文章中,研究人员通过生化实验分析蛋白乙酰化状态,证明了蛋白N末端α-乙酰化受到乙酰辅酶A(acetyl-CoA)的调控——乙酰辅酶A是乙酰基的活化形式,参与各种乙酰化反应,也是糖类、脂肪、氨基酸氧化时的重要中间产物。
生物探索推荐英文论文摘要:
Acetylation of Yeast AMPK Controls Intrinsic Aging Independently of Caloric Restriction
Acetylation of histone and nonhistone proteins is an important posttranslational modification affecting many cellular processes. Here, we report that NuA4 acetylation of Sip2, a regulatory β subunit of the Snf1 complex (yeast AMP-activated protein kinase), decreases as cells age. Sip2 acetylation, controlled by antagonizing NuA4 acetyltransferase and Rpd3 deacetylase, enhances interaction with Snf1, the catalytic subunit of Snf1 complex. Sip2-Snf1 interaction inhibits Snf1 activity, thus decreasing phosphorylation of a downstream target, Sch9 (homolog of Akt/S6K), and ultimately leading to slower growth but extended replicative life span. Sip2 acetylation mimetics are more resistant to oxidative stress. We further demonstrate that the anti-aging effect of Sip2 acetylation is independent of extrinsic nutrient availability and TORC1 activity. We propose a protein acetylation-phosphorylation cascade that regulates Sch9 activity, controls intrinsic aging, and extends replicative life span in yeast.







