摘要:据美国物理学家组织网近日报道,最近,杜克大学工程师对正常情况下不活跃的细胞进行了基因改造,引入了能形成离子通道的基因,让它们能产生电流并导电。该结果对深入研究生物电行为、开发神经系统和心脏病新疗法具有重要意义,还可用于设计新型传感器来探测疾病和环境毒素等。实验结果发表在《自然—通讯》杂志上。
细胞间通讯能力对心脑组织来说尤其重要,而通讯功能要有电脉冲通过才能实现。离子通道是带电分子或离子进出细胞的门户,可将电流从一个细胞传导到下一个细胞。根据理论预测,要让哺乳动物心脏产生和传导电脉冲,有3种通道至关重要:钾离子通道、钠离子通道和一个间隙连接通道,间隙连接通道是一种支持细胞间电通讯的高度特殊结构。
研究人员引入了这3种特殊的离子通道,让正常情况下没有电活性的细胞产生了电活性。根据小鼠实验,在这些转基因细胞内部和细胞之间,具有修复较大间隙的能力。在实验中,他们设计了一个“S”型的路径,两端是普通的小鼠心脏活细胞群,在两群细胞之间要么充满不活跃细胞,要么充满转基因细胞,再分别对一端的心脏细胞群施加一个电脉冲刺激,在填充不活跃细胞的路径中,电脉冲传过开端心脏细胞后立刻消失了;在充满转基因细胞的路径中,电脉冲很快再生而且传过了3厘米长的“S”路径,引发了另一端细胞群放电;用电脉冲刺激路径中央的转基因细胞,电脉冲会向两个方向传播,激活两端的心脏细胞。此外,研究人员还证明,通过转基因改造能让不活跃的人类肾脏细胞变得活跃。
“心脏病突发会造成心肌损伤形成断路,不能跟周围的健康心肌细胞保持同步。” 杜克大学普拉特工程学院生物医学工程副教授内纳德·伯斯卡说,转基因活性细胞在治疗心脏病发作方面大有前景,还可用于开发治疗活组织紊乱的新疗法。
研究人员还指出,这种工程活性细胞在实验室里很容易培养,它们在基因和功能上都是一致的,如果进一步改造还能改变它们的电性能和结构性质,可以作为研究特殊离子通道的平台,在组织水平上研究生物电行为,测试新药和新疗法的效果等。
生物探索推荐英文论文摘要:
Engineering biosynthetic excitable tissues from unexcitable cells for electrophysiological and cell therapy studies
Abstract:
Patch-clamp recordings in single-cell expression systems have been traditionally used to study the function of ion channels. However, this experimental setting does not enable assessment of tissue-level function such as action potential (AP) conduction. Here we introduce a biosynthetic system that permits studies of both channel activity in single cells and electrical conduction in multicellular networks. We convert unexcitable somatic cells into an autonomous source of electrically excitable and conducting cells by stably expressing only three membrane channels. The specific roles that these expressed channels have on AP shape and conduction are revealed by different pharmacological and pacing protocols. Furthermore, we demonstrate that biosynthetic excitable cells and tissues can repair large conduction defects within primary 2- and 3-dimensional cardiac cell cultures. This approach enables novel studies of ion channel function in a reproducible tissue-level setting and may stimulate the development of new cell-based therapies for excitable tissue repair.
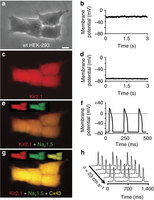
Figure 1: Stable coexpression of three genes confers impulse conduction in unexcitable cells.
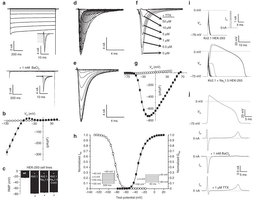
Figure 2: Stable expression of Kir2.
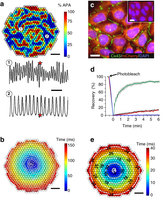
Figure 3: Stable overexpression of Cx43 in Kir2.







