人们长期认为不稳定的分子活性氧(reactive oxygen species, ROS)通过造成DNA损伤和激活癌基因(oncogene)的方式促进癌症产生,但是根据2011年7月6日在线发表在Nature杂志上的一篇论文上提供的新数据表明ROS实际上可能抑制肿瘤生长。
抗氧化剂能清除细胞中的ROS,也被用来治疗癌症。而这一发现表明抗氧化剂可能造成的害处要比好处大---造成并发症,而不是阻止疾病发生。
诺特丹大学(University of Notre Dame)的一名癌症生物学者Zachary Schafer在一封电子邮件中说,“这是一项杰出的和非常有意义的研究,进一步表明ROS在肿瘤发生过程中所起的双重作用”。2009年,Schafer证实消除ROS有助于肿瘤细胞在它们的胞外基质中存活。他说,类似地,这些新数据也加入到不断增加的研究文章列表当中,来挑战抗氧化剂发挥除去肿瘤细胞中致癌性ROS的作用因而人们认为它总是抗肿瘤发生的中心法则。
尽管如此,来自苏格兰邓迪大学(University of Dundee)研究癌症和抗氧化剂的John Hayes(未参与该项研究)在一封电子邮件上说,研究人员研究了一种已知能调节ROS清除的转录因子,而这种转录因子有很多其他的可能影响肿瘤细胞存活的重要功能。因此,ROS的肿瘤抑制作用迄今为止还没有得到直接地证实。
以前的研究表明癌细胞要比正常的细胞积累着更多的ROS,而且癌细胞中水平增高的ROS一直被认为一件不好的事情,促进细胞中DNA损伤、遗传不稳定性和药物抗性。然而,对诸如β-葫萝卜素和维生素E之类的清除ROS和阻止自由基损害的抗氧化剂的临床实验提供了复杂的结果,一些临床实验甚至表明抗氧化剂治疗导致癌症增加。
来自英国剑桥大学肿瘤研究所(Cancer Research UK Cambridge Research Institute)的David Tuveson和他的同事们注意到胰腺癌(pancreatic cancer)细胞似乎特别能够抵抗胁迫应激,并且追踪这种强有力的抵抗性后发现是因为胰腺癌细胞相对于正常的细胞而言含有较低水平的ROS。
该研究小组研究了转录因子 Nrf2 (具有降低细胞内ROS的作用)和它的抑制蛋白Keap1管理的一种已知的细胞抗氧化剂途径。他们发现了三种主要的癌基因Kras, Braf 和Myc在很多种人类癌症中表达,以及在肿瘤细胞中Nrf2水平的增加。Nrf2水平的增加积极地降低了细胞内ROS,清除了细胞中的自由基。
Tuveson说,“我们曾期待癌基因会导致ROS产生”,而不是除去ROS。因此,这个研究小组采用遗传学和药物学上的手段来阻断患有胰腺癌和肺癌的模式小鼠中Nrf2表达,来复核一下之前的研究结果。与早前的结果相符合的是,Nrf2的丧失产生了不能继续发展的小的早期肿瘤。Tuveson说,“我们发现Nrf2途径对于癌基因能够充分发挥功能是很重要的。”
这种令人吃惊的结果表明癌细胞在没有抑制ROS产生的Nrf2存在下,是不能够生长的。因此,有可能发生的是,人们使用药物或维生素来努力阻止癌症发生,可能实际上有助于癌细胞持续存活。这一发现有可能解释失败了的,甚至是有害的抗氧化剂临床实验结果。Tuveson说,“人们一直没有从分子水平去理解那些临床测试”,“如今,我们提出一种潜在性的新的科学假设来研究ROS和抗氧化剂如何与阻止癌症相关联”。
然而,Nrf2也指导细胞中许多其他途径中基因的转录,因此它对ROS的影响可能并不是全部的。Hayes说,“Nrf2调节大约100种有其他功能的基因”。他补充道,比如,Nrf2能展现出一种强有力的抗炎症效应,这种效应可能在允许肿瘤细胞存活上发挥着关键性的作用。因而,水平下降的ROS可能并不是Nrf2在肿瘤细胞存活过程中所造成的最重要的影响。
Tuveson领导的研究小组计划研究下一种可能性,探索Nrf2途径中哪些部分在促进肿瘤发生中是最重要的。
生物探索推荐英文原文:
Selective killing of cancer cells by a small molecule targeting the stress response to ROS
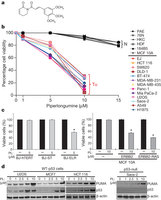
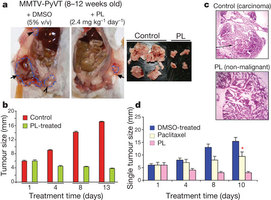
Abstract :Malignant transformation, driven by gain-of-function mutations in oncogenes and loss-of-function mutations in tumour suppressor genes, results in cell deregulation that is frequently associated with enhanced cellular stress (for example, oxidative, replicative, metabolic and proteotoxic stress, and DNA damage). Adaptation to this stress phenotype is required for cancer cells to survive, and consequently cancer cells may become dependent upon non-oncogenes that do not ordinarily perform such a vital function in normal cells. Thus, targeting these non-oncogene dependencies in the context of a transformed genotype may result in a synthetic lethal interaction and the selective death of cancer cells. Here we used a cell-based small-molecule screening and quantitative proteomics approach that resulted in the unbiased identification of a small molecule that selectively kills cancer cells but not normal cells. Piperlongumine increases the level of reactive oxygen species (ROS) and apoptotic cell death in both cancer cells and normal cells engineered to have a cancer genotype, irrespective of p53 status, but it has little effect on either rapidly or slowly dividing primary normal cells. Significant antitumour effects are observed in piperlongumine-treated mouse xenograft tumour models, with no apparent toxicity in normal mice. Moreover, piperlongumine potently inhibits the growth of spontaneously formed malignant breast tumours and their associated metastases in mice. Our results demonstrate the ability of a small molecule to induce apoptosis selectively in cells that have a cancer genotype, by targeting a non-oncogene co-dependency acquired through the expression of the cancer genotype in response to transformation-induced oxidative stress.
相关阅读:







