摘要:近日,由中国科学院北京基因组研究所所长吴仲义及其科学团队与国立台湾大学医学院陈定信院士、陈培哲院士共同合作开展的“肝癌癌症基因组合作研究”计划获最新进展,相关学术论文在在最新出版的PNAS杂志上发表。
“肝癌癌症基因组合作研究”计划于2009启动,作为基因组所一项长期的癌症基因组合作研究计划,其主要目的是分析肿瘤基因组序列改变,并通过其研究结果对获得新的癌症诊断治疗方法起到积极的作用。经过2年的合作研究,该计划已经获得了越来越多的成果,同时对肿瘤的发生、发展有了更多新的认识。此次发表的学术论文则报告了该计划的第一例肝癌全基因组最新研究成果。
目前,癌症是人口死亡的第二大主因,如肝癌、肺癌、食管癌和胃癌的5年生存率均不超过30%,其中肝癌仅为5%-6%。癌症死因主要是癌症的转移与复发,为此“癌转移”已成为21世纪生命科学急需要解决的问题。肝癌是全球第三位癌症杀手,在我国则居第二位,肝癌的治疗以手术治疗为主,但即使早期切除,5年内仍有半数患者转移复发。近年来开展的肝癌局部治疗,其转移复发率比切除还要高,即使作肝移植,癌转移复发仍然是首要问题。
癌细胞与正常细胞行为不一样的遗传因素是癌细胞基因组里有一些基因突变。随着第二代测序技术在成本和数据产出上的巨大发展与突破,科学家们可以通过比较不同癌细胞和正常细胞的基因组,获得癌细胞中发生突变的基因,同时也可以了解这些突变发生的先后顺序,并结合演化的观点更为直接地推断肿瘤的演化过程。
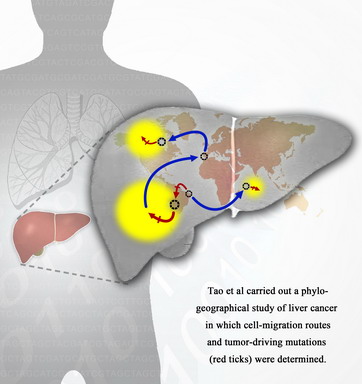
在此次研究发现中,研究人员通过追踪一例肝癌病人肿瘤细胞的DNA改变过程,对改例病例的原位以及肝内转移肿瘤进行了全基因组测序,并鉴定该例病例中基因突变及其发生的先后顺序。虽然肿瘤细胞通常积累了成千上万的突变,通过演化的观点分析研究人员界定出3个关键的基因突变,因为这3个突变均刚发生于肿瘤细胞群体迅速膨胀之前。
以往认为,复发肿瘤一般是由原位肿瘤细胞的后代发展而来,在这一例的研究中研究人员观察的2个复发肿瘤的基因组发现,复发肿瘤1的确是原位癌的直接后代,而复发肿瘤2更像是原位癌的兄弟克隆,而非子代克隆。而这意味在原位癌获得快速生长能力之前,肿瘤细胞就发生了转移,这也丰富了人们对“复发肿瘤”的认识。
基因组所肝癌全基因组合作研究取得新进展
生物探索推荐英文论文摘要:
Rapid growth of a hepatocellular carcinoma and the driving mutations revealed by cell-population genetic analysis of whole-genome data
Abstract
We present the analysis of the evolution of tumors in a case of hepatocellular carcinoma. This case is particularly informative about cancer growth dynamics and the underlying driving mutations. We sampled nine different sections from three tumors and seven more sections from the adjacent nontumor tissues. Selected sections were subjected to exon as well as whole-genome sequencing. Putative somatic mutations were then individually validated across all 9 tumor and 7 nontumor sections. Among the mutations validated, 24 were amino acid changes; in addition, 22 large indels/copy number variants (>1 Mb) were detected. These somatic mutations define four evolutionary lineages among tumor cells. Separate evolution and expansion of these lineages were recent and rapid, each apparently having only one lineage-specific protein-coding mutation. Hence, by using a cell-population genetic definition, this approach identified three coding changes (CCNG1, P62, and an indel/fusion gene) as tumor driver mutations. These three mutations, affecting cell cycle control and apoptosis, are functionally distinct from mutations that accumulated earlier, many of which are involved in inflammation/immunity or cell anchoring. These distinct functions of mutations at different stages may reflect the genetic interactions underlying tumor growth.







