竞争性抑制的特点及其Ki和IC50值的求解方法
竞争性抑制作用中,抑制剂与底物对酶的结合有竞争作用,互相排斥。而底物又不能与EI结合,抑制剂也不能与ES结合,所以
EIS不存在,就是说Ki’和Ks’的值都是无穷大(∞)。
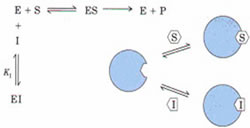
酶底物方程
竞争性抑制剂的结构特征
①底物类似物例如,α-葡糖苷酶抑制剂如阿卡波糖(acarbose)、伏格列波糖(voglibose)和米格列醇(Miglitol)
②过渡态类似物 如苯甲酰丙氨醛是胰凝乳蛋白酶的过渡态抑制剂。
③其它化合物 有些化合物的平面结构与底物并不相似,但立体构象十分相近,也成为竞争性抑制剂。某些竞争性抑制剂的作用原理是抑制剂与一些酶活性中心的金属离子络合,妨碍了底物的进入,从而起到抑制酶活性的目的。
竞争性抑制作用的双倒数方程
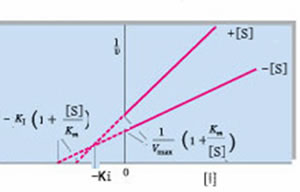
双倒数方程
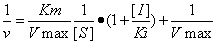
以此方程所作曲线和各参数的值如下图所示:
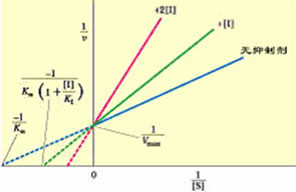
双倒数方程曲线
更详细的分析,可以由此参考双倒数方程与米氏常数相关的资料。
竞争性抑制作用Ki的求解方法
①从双倒数图计算出表观米氏常数Kmapp,然后代入Kmapp=Km(1+[I]/Ki)可计算出Ki。
②从双倒数图求得各I浓度下的Kmapp值对相应[I]再作图,从再制图的纵截距可直接测得Km,从其横截距可直接测得Ki。
③从不同固定[I]下所作一簇直线的斜率1/S对相应[I]再制图,其纵截距为Km/Vmax, 斜率为Km/VmaxKi,横截距即为-Ki。
④Dixon作图法求Ki值
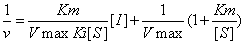
Dixon方程
Dixon曲线
竞争性抑制剂的IC50值的计算公式
首先由此查看有关IC50的定义。它的值取决于实验所用的酶和底物浓度,当酶的浓度固定时,IC50值与Ki、Km和底物浓度[S]呈如下关系:
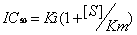
竞争性抑制剂IC50值
根据该方程式,当底物浓度大于Km值时,IC50值高于Ki值,尤其当底物浓度较高时,Ki值偏低更加明显。
以下版权声明必须遵守,转载时必须以链接的形式注明如下信息:
原载于 散人笔记
原文地址 https://www.eryi.org/blog/post/competitibe-inhibition-ic50.html







