导语:7月17日,美国礼来(LLY.US)在阿尔茨海默病协会国际会议(AAIC)上公布了阿尔茨海默病治疗药物(Donanemab)的三期临床试验结果:Donanemab对处于疾病早期阶段的试验参与者更有益,与安慰剂受试者相比,接受Donanemab治疗的受试者认知和功能的下降减缓了60%,临床痴呆评定量表(CDR-SB)显示,患者认知能力衰退减缓了46%。
礼来表示已向美国食品药品监督管理局(FDA)提交了阿尔茨海默病新药Donanemab的上市申请,FDA预计2023年年底前做出决定。此外,礼来正在向其他全球监管机构提交文件,其中大部分将在年底前完成。若获得全面批准,Donanemab将成为继日本卫材药业(Eisai)和美国渤健公司(Biogen)联合开发的Leqembi(通用名:Lecanemab)之后的第二个“里程碑”,或于今年年底与Leqembi分庭抗礼。
β-淀粉样蛋白(一种粘性的神经元损伤蛋白)在大脑中的沉积导致神经原纤维缠结和其他特征性大脑变化,是阿尔茨海默病(Alzheimer's disease,AD)的早期事件。清除淀粉样蛋白斑块,是AD药物开发的主要目标之一。Donanemab和Leqembi都是通过清除β-淀粉样蛋白斑块起作用。
Donanemab是一种单克隆抗体,可与β-淀粉样蛋白结合,并通过脑小胶质细胞介导的吞噬作用帮助去除斑块。2023年5月,礼来公司公布了Donanemab顶线数据(topline data):Donanemab每四周给药一次,在18个月内将某些早期阿尔茨海默病患者的认知和功能下降速度减缓了35%。相对而言,Leqembi的3期关键临床试验数据显示:每两周给药一次,在18个月内使阿尔茨海默病患者的认知和功能下降速度减缓了27%。
7月17日,礼来在JAMA Network发表了Donanemab3期试验TRAILBLAZER-ALZ 2的完整数据。TRAILBLAZER-ALZ 2是一项为期76周、3期、随机、双盲、平行、多中心、安慰剂对照试验,在8个国家277个地点对参与者进行了筛选,最终纳入1736名(平均年龄73岁;76%完成了试验)患有早期症状明显的AD以及淀粉样蛋白和tau病变的参与者。参与者以1:1的比例随机分配,每4周静脉注射多纳奈单抗(n=860)或安慰剂(n=876),持续72周。如果满足剂量完成标准,Donanemab组的参与者将以盲法方式转为接受安慰剂。
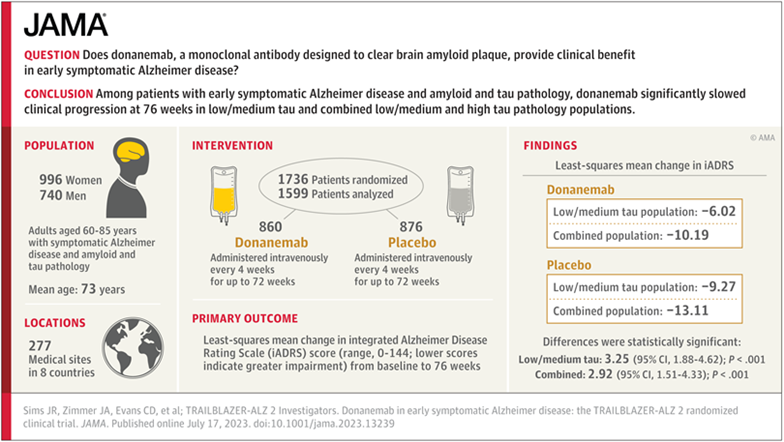
图1 研究概览(图源:[1])
在76周时,AD综合评分量表(iADRS)的最小二乘平均值变化(范围为0-144;得分越低表示损伤越严重)为:在低/中tau人群中,Donanemab组为-6.02,安慰剂组为-9.27;在综合研究人群中,Donanemab组为-10.19,安慰剂组为-13.11,两者均有显著差异。
亚组分析结果表明,Donanemab对处于疾病早期阶段的试验参与者更有益,在75岁以下的人群中,iADRS显示临床衰退速度减缓了48%,临床痴呆评定量表(CDR-SB)减缓了45%;而对于75岁或以上的参与者,这两个数字分别为25%和29%。整体而言,与安慰剂受试者相比,接受Donanemab治疗的受试者认知和功能的下降减缓了60%,CDR-SB显示患者认知能力衰退减缓了46%。
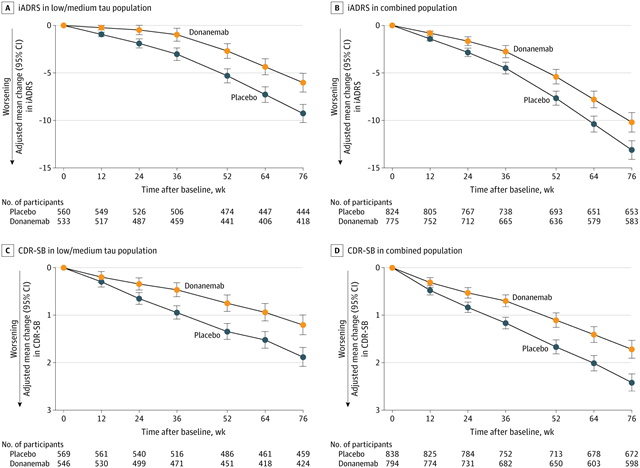
图2 从基线到76周的iADRS和CDR-SB的方框总和(图源:[1])
在不良事件(AE)方面,Donanemab与Lecanemab和相关药物Aducanumab一样,可引起淀粉样蛋白相关成像异常(ARIA),有时会导致潜在致命的脑出血和癫痫发作。礼来III期试验中13.1%的使用Donanemab的患者因不良事件(包括注射反应和ARIA-E)而停止治疗,约有25%的参与者患有ARIA,其中三人死于该病。
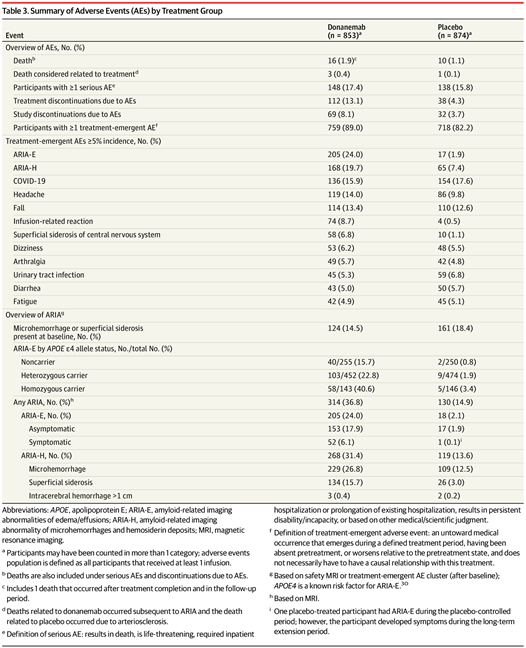
图3 按治疗组划分的不良事件总结(图源:[1])
ARIA在携带APOE4遗传变异的研究参与者中最为常见,死亡的3人中有2个人携带一个拷贝的APOE ε4遗传标记,该遗传标记与AD早期风险增加相关。APOE ε4携带者患ARIA-E的风险增加,携带两个APOE ε4等位基因拷贝的人的患ARIA-E比率最高,为40.6%,拥有APOE ε4等位基因拷贝的人患有ARIA-E的比率为22.8%,非携带者中这一比率为15%。
此项临床试验仍有不足之处。限时给药的固有局限性在于接受的Donanemab总剂量和给药持续时间的变化;研究的人群主要是白人(91.5%),白人以外的种族和民族亚组的结果在统计学上并不显著,缺乏种族和民族多样性,可能会限制对其他人群的普遍适用性;数据收集只持续76周,限制了对Donanemab的长期了解;试验是在新冠大流行期间进行的,新冠感染是治疗组中最常报告的不良事件,对结果带来影响;由于试验设计差异,无法将结果与其他淀粉样蛋白靶向试验进行直接比较;淀粉样蛋白相关的影像学异常和输注相关反应的发生可能导致参与者和研究者推断治疗分配。
礼来神经科学研发副总裁Mark Mintun表示:“白人以外人数非常少,置信区间非常广泛。在即将进行的一项安全性试验和一项针对有AD风险的人的预防研究中,礼来已经在患者招募中增加种族和民族多样性。”
美国哥伦比亚大学神经心理学教授Jennifer Manly和加州大学洛杉矶分校Kacie Deters教授均表示:“在来自美国的1251名试验参与者中,只有两名是美洲印第安人或阿拉斯加原住民,11名是亚洲人,34名是黑人,71名是西班牙裔。Donanemab试验没有提供足够的证据证明美洲印第安人、阿拉斯加原住民、亚洲人、黑人或西班牙裔种族的安全性或有效性。”
马萨诸塞州波士顿塔夫茨大学Brent Forester教授担心Donanemab和其他药物在临床实践中的作用。目前尚不清楚医生是否应该复制试验设计,并在人们大脑中不再含有淀粉样蛋白后停止使用该药物。筛查ARIA可能既昂贵又困难,确定最有可能从治疗中受益的人也是如此。
加州大学旧金山分校Eric Widera及其同事在JAMA随附的社论中表示:“撇开关于安全性和有效性的争论不谈,2023年淀粉样蛋白抗体将从严格控制的临床试验世界转移到现实世界,现在重要的是获取数据,无论(这些数据)多么不完美。”